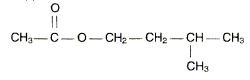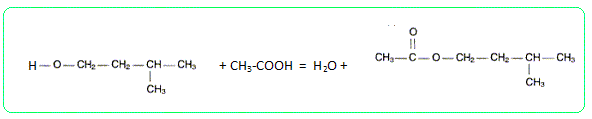|
Préparation d'une phéromone, constante d'équilibre ( bac S Inde 2009). En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Les phéromones sont des espèces chimiques servant à la communication au sein d'espèces vivantes. De nombreuses phéromones d'insectes sont des molécules relativement simples. On étudie la synthèse d'une phéromone P, phéromone d'alarme chez les abeilles. La formule semi-développée de P est :
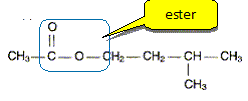
Dans un ballon de 100 mL, on introduit un volume VA = 14,3 mL d'acide éthanoïque et une masse m= 22,0 g d'alcool B. On ajoute 1 mL d'acide sulfurique concentré et quelques grains de pierre ponce. On adapte un réfrigérant à boules sur le ballon et on chauffe à reflux pendant 4 heures. Après extraction on obtient mp=21,7 g de phéromone P. Réaction de synthèse. Sur la formule semi développée de P entourer le groupement fonctionnel présent et donner le nom de ce groupement.
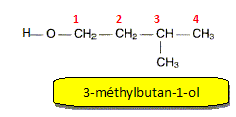
Donner la formule semi-développée et le nom de l'alcool B. Ecrire
l'équation de la réaction de
synthèse permettant d'obtenir la
molécule de la phéromone
P. Préciser les deux caractéristiques principales de cette transformation. Estérification lente et limitée par l'hydrolyse de l'ester. Pourquoi chauffe t-on le mélange acide alcool ? La température est un facteur cinétique : en chauffant on accélère la réaction. L'équilibre est plus rapidement atteint, mais sa composition n'est pas modifiée. Quel est l'intérêt d'un dispositif à reflux ? Ce dispositif permet de travailler à température modérée tout en évitant les pertes de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le ballon. Quel matériel choisir pour mesurer le volume VA d'acide éthanoïque ? Un volume précis, VA = 14,3 mL, peut être mesuré à l'aide d'une burette graduée au 1/10ème .
Etude quantitative de la réaction. Calculer les quantités de matière initiales nA 0 et nB 0 de chacun des réactifs. Masse d'acide : 14,3*1,05 = 15,015 g nA 0 = m/M = 15,015 / 60,0 = 0,250 mol. nB 0 = m/M = 22,0 / 880,0 = 0,250 mol. Compléter le tableau d'avancement :
0,250-xmax = 0 ; xmax = 0,250 mol.
Donner la relation liant la quantité nP de phéromone formée dans l'état final et l'avancement final xf. xf= nP = mP/MP = 21,7 / 130 = 0,16692 ~ 0,167 mol. Exprimer et calculer le taux d'avencement final t ( ou rendement) de cette réaction. t = xf / xmax= 0,16692 / 0,250 = 0,668. Définir la constante d'équilibre K associée à cette réaction. K = [P]f [E]f / ([CH3COOH]f [B]f ) Exprimer K en fonction de xf, nA 0 et nB 0. K = xf2 / ((nA 0 -xf ) (nB 0 -xf)) Montrer que K = 4,0. K = 0,16692 / ( 0,0831*0,0831 ) =4,0.
Augmentation du rendement d'une réaction. Des élèves font des propositions pour augmenter le rendement de cette réaction ; pour chaque proposition précisez si vous êtes en accord ou en désaccord avec ces élèves et pour quelle raison. A- Ajouter une plus grande quantité d'acide sulfurique concentré dans le mélange réactionnel. Faux. L'acide sulfurique joue le rôle de catalyseur : il accélère la réaction mais ne modifie pas la composition du système à l'équilibre. B- Eliminer l'eau par distillation au fur et à mesure de sa formation. Vrai. L'eau est l'espèce la plus volatil ; en éliminant un produit au fur et à mesure qu'il se forme, on déplace l'équilibre dans le sens direct. C- Remplacer l'acide éthanoïque par l'anhydride éthanoïque. Vrai. Dans ce cas la réaction est totale ( absence d'eau : l'ester ne peut pas subir d'hydrolyse).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|