|
L'eau distillée et son pH ( bac S Antilles 2009). En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
pH de l'eau pure à 25 °C. Dans toute solution aqueuse se produit la réaction d'autoprotolyse de l'eau. Ecrire l'équation de cette réaction. 2 H2O (l) = H3O+aq + HO- aq. Exprimer la constante d'équilibre Ke associée à l'équation précédente. Quel nom donne t-on à cette constante ? Ke = [H3O+aq ]éq [HO- aq]éq. On appelle cette constante produit ionique de l'eau. A 25°C des mesures de conductivité électrique montrent que pour l'eau pure : [H3O+aq ]éq = [HO- aq]éq = 1,0 10-7 mol/L. Calculer la valeur de Ke à 25 °C. Ke = 1,0 10-7 * 1,0 10-7 = 1,0 10-14. pH = - log
H3O+aq ] =
- log (1,0 10-7) =
7,0. De l'eau fraîchement distillée et laissée à l'air libre dans un becher, à 25 °C, voit son pH diminuer progressivement puis se stabiliser à la valeur 5,7. La dissolution lente et progressive dans l'eau distillée du dioxyde de carbone présent dans l'air permet d'expliquer cette diminution du pH. Un équilibre s'établit entre le dioxyde de carbone présent dans l'air et celui qui est dissout dans l'eau distillée noté CO2, H2O. Le couple dioxyde de carbone dissous / ion hydrogénocarbonate est CO2, H2O / HCO3- aq. L'équation de la réaction entre le dioxyde de carbone dissous et l'eau s'écrit : CO2, H2O +H2O (l) = HCO3- aq + H3O+aq. Ecrire les couples acido-basiques mis en jeu dans cette équation. CO2, H2O / HCO3- aq et H3O+aq / H2O (l). Exprimer la constante d'acidité Ka associée à l'équation précédente. Ka = [HCO3- aq] [H3O+aq] / [CO2, H2O]. Montrer qu'à aprtir de l'expression de Ka on peut écrire : pH = pKa + log ( [HCO3- aq] / [CO2, H2O] ) log Ka = log [H3O+aq] + log ( [HCO3- aq] [ / [CO2, H2O] ) -log Ka = -log [H3O+aq] - log ( [HCO3- aq] [ / [CO2, H2O] ) pKa = pH - log ( [HCO3- aq] / [CO2, H2O] ) pH = pKa + log ( [HCO3- aq] / [CO2, H2O] ).
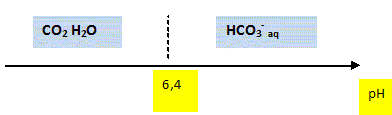
Sachant que pKa = 6,4 calculer la valeur du quotient [HCO3- aq] / [CO2, H2O] pour de l'eau distillée de pH=5,7. Quelle espèce prédomine dans l'eau distillée à pH=7 ? log ( [HCO3- aq] / [CO2, H2O] ) = pH - pKa = 5,7-6,4 = -0,7 [HCO3- aq] / [CO2, H2O] = 10-0,7 = 0,20. HCO3- aq est minoritaire ; CO2, H2O est majoritaire. A pH inférieur à pKa, la forme acide du couple acide base prédomine. Tracer le diagramme de prédominance des espèces HCO3- aq et CO2, H2O.
Compléter le tableau d'avancement en fonction de V ( volume considéré d'eau distillée) et de c ( concentration apportée en dioxyde de carbone).
HCO3- aq]éq = [H3O+aq]éq = xf / V = 10-pH = 10-5,7 = 2,0 10-6 mol/L. Déderminer la valeur de [CO2, H2O]éq. [HCO3- aq]éq / [CO2, H2O]éq = 0,20 ; [CO2, H2O]éq =[HCO3- aq]éq /0,2 = 2,0 10-6 / 0,2 =1,0 10-5 mol/L. En déduire la valeur de c. Conservation de l'élément carbone : c = [HCO3- aq]éq + [CO2, H2O]éq c = 2,0 10-6 + 1,0 10-5 = 1,2 10-5 mol/L.
|
|||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
|
|