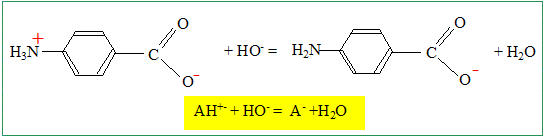|
Filtres et écran solaires, dosage acide base d'une solution de Paba, concours Mines 07 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
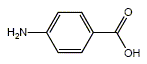
Les filtres minéraux (écrans inorganiques) sont constitués d’oxyde de zinc ou d’oxyde de titane sous forme de particules ; ils sont stables et ne provoquent pas d’allergie. Leur fonction principale est d’absorber et de diffuser les rayons UV. On utilise des particules de petite taille : 40 à 50 nm (nanoparticules) car elles ne diffusent que le bleu (les particules plus grosses diffusent aussi les autres longueurs d’onde du visible, ce qui donne un aspect blanc). Sachant que la transition entre les niveaux d’énergie correspond à environ 3,3 eV, déterminer la valeur correspondante de la longueur d’onde absorbée par un écran d’oxyde de zinc et préciser le domaine de la longueur d’onde calculée. Données : 1 eV = 1,6 10-19 J ; c = 3,0 108 m/s ; h = 6,62 10-34 J s. Le rayonnement UV se décompose en UV A (315-380 nm), UV B (280-315 nm) et UV C (10-280 nm). 3,3 eV = 3,3 *1,6 10-19 J = 5,28 10-19 J. E= hc/l l = hc/E = 6,62 10-34 * 3,0 108 /5,28 10-19 ; l = 3,76 10-7 m = 376 nm. Domaine d'ondes : proche UVA. Les filtres organiques sont des substances dont l’action photoprotectrice est due à leur capacité à absorber une partie du rayonnement UV. L’acide 4-aminobenzoïque (ou acide paraaminobenzoïque) est nommé PABA dans la nomenclature internationale des constituants cosmétiques. Il absorbe à 296 nm. Il existe une grande famille des dérivés du PABA qui présentent un spectre étroit d’absorption aux environs de 300 nm. Ces filtres organiques dérivés du PABA ne sont pas tous stables (dégradation dans le temps) et peuvent aussi provoquer des allergies.
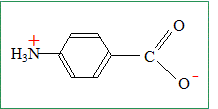
L’acide
4-aminobenzoïque est un acide aminé ;
il contient un groupe aux propriétés
acides et un groupe aux propriétés
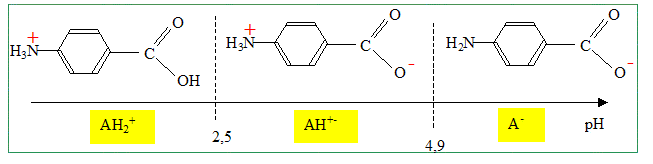
basiques. pKa1 = 2,5 :
pKa2 = 4,9. Indiquer les électrodes nécessaires à la réalisation un titrage pH-métrique, en précisant le rôle de chacune. Electrode combinée. ou bien électrode de verre ( pour la mesure du pH) et une électrode au calomel saturée ( référence).
Calculer la valeur de la constante d’équilibre correspondante. K = [A-] / ([AH+-][HO-]) Or AH+- + H2O =A- + H3O+ ; Ka2 = [A-] [H3O+] / [AH+-] soit [A-] / [AH+-] = Ka2 /[H3O+] par suite : K= Ka2 /( [H3O+] [HO-] ) ; K= Ka2 / Ke. K = 10-4,9 / 10-14 = 109,1. Quelle est la concentration de la solution d’acide 4-aminobenzoïque ? A l'équivalence du dosage les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. VA CA = CB VBE ; CA = CB VBE / VA = 1,00.10-1 * 10,3 / 100 ; CA =1,03 10-2 mol/L. Quelle est la valeur approchée du pH de la solution à la demi-équivalence ? Justifier. Le couple AH+-/ A- fixe le pH. pH = pka2 + log ( [A-] /[AH+-]) A la demi équivalence on a versé 5,15 mL de soude soit 0,515 mmol d'ion hydroxyde. Ces derniers ont réagi avec 0,515 mmol de AH+- pour conduire à 0,515 mmol d'ion A-. Il reste donc 1,03-0,515 = 0,515 mmol d'ion AH+-. La quantité de matière d'ion AH+-est donc égale à la quantité de matière d'ion A-. [A-] =[AH+-] et en conséquence pH=pKa2 = 4,9.
|
|||||||
|
|
|||||||
|
|