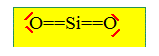|
propriétés chimiques de la silice ; cinétique d'ordre 1 : loi d'Arrhénius concours Mines 04 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Structure : Ecrire la configuration électronique dans l’état fondamental du silicium de numéro atomique Z=14. Citer un élément de la même colonne. 1s2 2s2 2p6 3s2 3p2 ; éléments carbone, germanium. Le silicium existe à l’état naturel sous les trois formes isotopiques suivantes : 2814Si : 92,2 % ; 2914Si : 4,7 % ; 3014Si : 3,1 % ; Estimer la masse molaire atomique moyenne de l'élément Si. M= 28*0,922 + 29*0,047+30*0,031 = 28,1 g/mol. La masse molaire de l’oxygène étant de 16 g/mol, quelle est la masse molaire moyenne de la silice SiO2 ? 28,1 + 32 = 60,1 g/mol. On rappelle que le numéro atomique de l’oxygène est Z=8. Proposer alors un schéma de Lewis de la molécule SiO2. Quelle est la géométrie de cette molécule ? Citer une molécule de géométrie analogue à celle de SiO2. Si : 4 électrons de valence ; O : 6 électrons de valence.
type AX2, linéaire comme CO2.
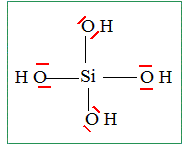
La silice en solution aqueuse : On trouve de la silice minérale sous forme, par exemple, d’anorthite de formule chimique CaAl2Si2O8. L’altération de cette silice minérale par l’acide carbonique (CO2 dissous formant l’acide H2CO3), présent dans les eaux de pluie, souterraines et fluviales, libère de la silice dissoute, que l’on notera DSi dont la formule chimique est H4SiO4. La réaction de dissolution est la suivante : CaAl2Si2O8+ xH2CO3 + yH2O = 2Al(OH)3 + Ca2+ + a H4SiO4 + b HCO3-. Proposer une formule de Lewis de la silice dissoute DSi. CaAl2Si2O8+
2
H2CO3 +
6
H2O = 2Al(OH)3 +
Ca2+ + 2
H4SiO4 + 2
HCO3-. (1) SiO2 (s) + 2H2O = H4SiO4 ; K1 = 10-2,7 à 25°C. Calculer, à l’équilibre, la concentration en DSi à 25°C ? K1 =[H4SiO4] = 10-2,7 =2,0 10-3 mol/L. En déduire la masse maximale de silice pure amorphe que l’on peut dissoudre dans un volume de 1 L d’eau pure. 2,0 10-3*M(SiO2) = 2,0 10-3*60,1 = 0,12 g/L.
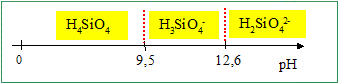
Sachant que le pH des eaux naturelles est généralement compris entre 7 et 8, quelle est la forme prédominante en solution de la silice ? à pH < 9,5 , la forme H4SiO4 prédomine. Pour une eau dont le pH est compris entre 10 et 12, écrire l’équation bilan de dissolution de la silice (en milieu basique). Calculer la constante K'2 de cet équilibre en fonction de K1, K2 et Ke (produit ionique de l’eau). H3SiO4- prédomine dans ce domaine de pH. SiO2 (s) + H2O + HO- = H3SiO4- ; K'2 = [H3SiO4-] / [HO-] ; Or : K2 =[H3SiO4-][H3O+] / [H4SiO4] et K1 =[H4SiO4] K'2 = K2 [H4SiO4]/ ( [HO-][H3O+]) ; K'2 = K2K1 /Ke. K'2 = 10-9,5 . 10-2,7 / 10-14 =10+1,8 =63.
Pour une eau dont le pH est compris entre 13 et 14, écrire l’équation bilan de dissolution de la silice (en milieu basique). Calculer la constante K'3 de cet équilibre en fonction de K1, K2, K3 et Ke. H2SiO42- prédomine dans ce domaine de pH. SiO2 (s) + 2HO- = H2SiO42- ; K'3 = [H2SiO42-] / [HO-]2 ; Or : K2 =[H3SiO4-][H3O+] / [H4SiO4] ; K1 =[H4SiO4] et K3 =[H2SiO42-][H3O+] / [H3SiO4-] K2K3 =[H3O+]2[H2SiO42-]/ [H4SiO4] K'3 = K2 K3 [H4SiO4]/ ( [HO-]2[H3O+]2) ; K'3 = K3 K2K1 /Ke2. K'3 = 10-12,6.10-9,5 . 10-2,7 / 10-28 =103,2 =1,6 103. Cinétique de dissolution de la silice biogénique dans l’eau : La silice peut être incorporée par des organismes vivants, comme les diatomées ou les radiolaires. On parle alors de silice biogénique, SiO2 ou BSi. Des études récentes ont montré que cette silice, d’origine semi-aquatique ou même terrestre, pouvait avoir un rôle important dans les cycles biogéochimiques. Quand la silice est incorporée dans les plantes, on parle de phytolithes. Ces phytolithes s’accumulent dans les estuaires des fleuves. On se propose d’étudier la cinétique de dissolution des phytolithes dans l’eau des fleuves. Pour étudier la dissolution en laboratoire, on place une certaine quantité initiale nB0=10-3 mol de silice biogénique, dans un volume V0 =1 L d’eau. La silice biogénique se présente sous la forme de microcristaux que l’on suppose répartis de manière uniforme dans l’eau. On définit alors à l’instant t une concentration en silice biogénique par le rapport nB(t)/V0. L’expérience est réalisée à 60°C, en bain-marie agitant, avec adjonction de chlorure de sodium à 0,7 mol/L et en présence d’un tampon à pH=8. La silice biogénique va se dissoudre pour former de la silice DSi (H4SiO4) que l’on sait doser au cours du temps. L’équation de dissolution est : BSi + 2 H2O = DSi. Pourquoi utilise-t-on un tampon à pH=8 ici ? H4SiO4 est la forme prédominante à pH =8. De plus, le pH des eaux naturelles est proche de 8. Pourquoi l’expérience est réalisée à une température de 60°C alors que dans les conditions naturelles, les eaux sont à moins de 20°C ? La température est un facteur cinétique : à 60°C, la vitesse de la réaction de dissolution est beaucoup plus grande qu'à 20 °C.
La silice dissoute est dosée par une technique de spectrophotométrie assez délicate à mettre en oeuvre ici. On relève au cours du temps la concentration en mmol/L de silice dissoute DSi. Le tableau des relevés est donné ci-dessous.
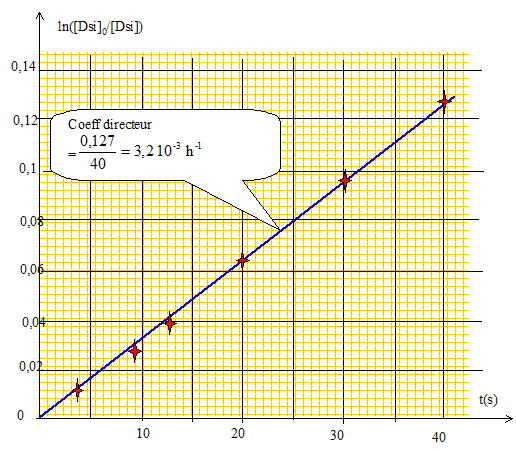
On appellera k la constante de vitesse. BSi + 2 H2O = DSi. v = -d[BSi]/dt = k[BSi] ; d[BSi]/ [BSi] = -k dt ; d ln[BSi] = -k dt Intégrer entre t=0 et t : ln[BSi] -ln [BSi]0 = -kt ; [BSi] = [BSi]0 exp(-kt). [DSi] = [BSi]0 -[BSi] =nB0/V0(1-exp(-kt). Quelle courbe faut-il tracer en fonction du temps pour vérifier l’hypothèse d’un ordre 1 ? ln ( [BSi]0 /[BSi] )= f(t), droite de coefficient directeur k. Par une régression linéaire ou par une méthode graphique, vérifier que la cinétique est bien d’ordre 1. En déduire la valeur de k.
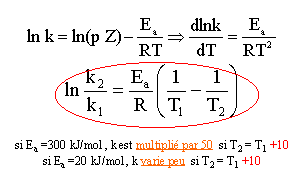
Dans l’hypothèse où k suit la loi d’Arrhénius, exprimer la constante de vitesse k2 à la température T2 en fonction de la constante de vitesse k1 à la températureT1.
Calculer alors numériquement la constante de vitesse de la dissolution à température de 20°C. T1 = 293 K ; T2 = 333 K ; k2 = 3,2 10-3 h-1 ; Ea=6 104 Jmol-1 ln(k2/k1) = 6 104/8,314 [1/293-1/333]= 2,98 ; k2/k1 = e2,98 = 19,7 ; k1 = k2 /19,7 = 3,2 10-3 /19,7 =1,6 10-4 h-1 ; On donne l’énergie d’activation Ea=60 kJmol-1 ; R= 8,314 S.I la constante des gaz parfaits . Conclure. A 20 °C, la réaction est 20 fois plus lente qu'à 60°C : à 20 °C, l'expérience aurait durée plus d'un mois.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|