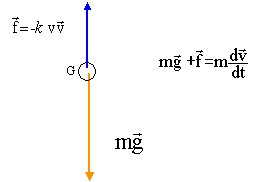|
Concours manipulateur électroradiologie médicale Toulouse 2007 chute d'un grélon ( Euler) ; solution d'ammoniac En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On étudie un grêlon de masse 13 g qui tombe d'un point O d'altitude 1 500 m sans vitesse initiale. Il peut être assimilé à une sphère de diamètre 3,0 cm. Le point O sera pris comme origine d'un axe Oz orienté positivement vers le bas. L'intensité de la pesanteur sera considérée comme constante et de valeur g0 = 9,80 m.s-2 . Données : volume d'une sphère V = 4/3 p.r3 ; masse volumique de l'air r = 1,3 kg.m-3 . On admettra que le grêlon tombe en chute libre. Préciser le référentiel d'étude. Que signifie l'expression tomber en chute libre ? Référentiel terrestre supposé galiléen. La chute est dite "libre" lorsque l'objet n'est soumis qu'à son poids. Rappeler les conditions initiales du mouvement du grélon. Vitesse initiale nulle ; la position initiale du grêlon est choisie comme origine de l'axe verticale descendant. En appliquant la deuxième loi de Newton, déterminer les équations horaires donnant la vitesse et la position du centre d'inertie G du grêlon en fonction de la durée t de chute. En chute libre, le poids est la seule force appliquée : ma = mg d'où a=g. La vitesse est une primitive de l'accélération : v= gt ( vitesse initiale nulle) La position est une primitive de la vitesse : z= ½gt².( position initiale prise comme origine) Calculer la valeur de la vitesse lorsqu'il atteint le sol, ce résultat est-il vraisemblable ? Justifier. Repport
dans l'expression de la vitesse : v =
g[3000/g]½ =
[3000*g]½ =
[3000*9,8]½ = 171,5
m/s=617
km/h. Cette
valeur est bien trop grande pour correspondre
à la réalité , ainsi
qu'à la valeur proposée dans le
texte; on a négligé les forces de
frottements sur les couches d'air.
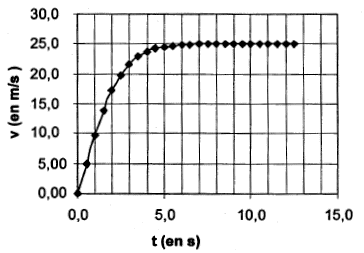
On veut résoudre cette équation différentielle par une méthode numérique : la méthode d'Euler. Le tableau suivant est un extrait d'une feuille de calcul des valeurs de la vitesse (v) et de l'accélération (a) en fonction du temps (t). Il correspond aux valeurs : A = 9,80 m.s-2 et B = 1,56.10-2 m-1 , pas de variation Dt = 0,5 s.
On utilise l'équation différentielle pour déterminer a4 : a4 = 9,8-1,56 10-2 v42 avec v4 = 17,2 m/s. a4 = 9,8-1,56 10-2* 17,22 = 5,18 m/s². Dans la méthode d'Euler, on utilise l'approximation suivante : a = Dv / D t. Dv = v5-v4= a4D t soit v5= v4+ a4D t v5= 17,2 + 5,18 * 0,5 = 19,8 m/s. Exprimer la vitesse limite atteinte par le grêlon en fonction de A et B puis calculer sa valeur numérique. Lorsque la vitesse limite est atteinte par le grêlon, la vitesse est constante, l'accélération a est alors nulle. 0= A-Bvl2 soit vl =(A/B)½= (9,8/1,56 10-2)½=25,1 m/s. - La courbe d'évolution de la vitesse en fonction du temps est donnée ci-dessous. Retrouver graphiquement la valeur de la vitesse calculée au paragraphe précédent. D'après
la courbe, l'asymptote horizontale donne la valeur de la
vitesse limite, valeur en accord avec celle calculée
ci-dessus. L'ammoniac NH3 est un gaz qui dissout dans l'eau donne une solution basique d'ammoniaque. Des solutions d'ammoniaque sont vendues dans le commerce. Ces solutions après dilution, sont utilisées comme produit nettoyant et détachant. On se propose d'étudier quelques propriétés de l'ammoniac dissout puis de déterminer sa concentration dans un de ces produits. Données : masse molaire de l'ammoniac : 17g/mol ; couple acide base NH4+ / NH3 : Ka1 = 6,3 10-10. I. NH3(aq) : L'ammoniac est une base en solution aqueuse. Donner la définition d'une base selon Brönsted. base : espèce, ion ou molécule susceptible de gagner un proton H+. Ecrire l'équation de la réaction entre l'ammoniac et l'eau. NH3 + H2O = NH4+ + HO-. Exprimer puis calculer la constante d'équilibre de cette réaction. K = [NH4+]éq[HO-]éq / [NH3 ]éq Or Ka1 = [NH3 ]éq[H3O+]éq / [NH4+]éq et Ke = [HO-]éq[H3O+]éq = 10-14 à 25°C K =
[NH4+]éq[H3O+]éq
[HO-]éq
/ [NH3
]éq[H3O+]éq=
Ke
/
Ka1
=10-14 /6,3 10-10=
1,59 10-5.
On dissout dans un volume d'eau V=250 mL une quantité de matière n d'ammoniac égale à 2,5 10-3 mol. Le pH de la solution S obtenue vaut 10,6. Calculer la concentration c en soluté apporté. concentration c en soluté apporté : c= n/V = 2,5 10-3 / 0,25 = 0,01 mol/L. Calculer la concentration en ion oxonium H3O+ dans la solution. concentration en ion oxonium H3O+ dans la solution : [H3O+]= 10-pH = 10-10,6 = 2,51 10-11 mol/L En déduire la concentration en ion hydroxyde HO- dans la solution. concentration en ion hydroxyde HO- dans la solution : [HO-]= 10-14 / [H3O+]= 10-14 / 2,51 10-11 = 4 10-4 mol/L. Montrer que le taux d'avancement
final t
peut s'écrire t=
[HO-]f / c puis le
calculer. xf = [HO-]f *V = 4 10-4 *0,25 = 10-4 mol/L t= xf / xmax = [HO-]f *V / (CV) = [HO-]f / C = 10-4 / 2,5 10-3 = 0,04. t
<<1 en
conséquence, la transformation est très
limitée.
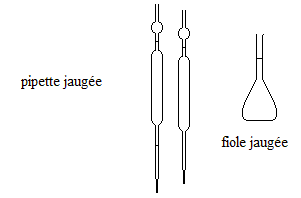
Détermination de la concentration en ammoniac de la solution commerciale : Dilution de la solution commerciale. Afin de déterminer la concentration c0 de la solution commerciale, on propose de réaliser un titrage acido-basique de la solution commerciale. Celle-ci étant très concentrée, on fabrique par dilution, une solution S1 de concentration c1 mille fois plus petite. Décrire le protocole expérimntal pour réaliser cette dilution. facteur de dilution = 1000 = volume fiole jaugée (mL)/ volume pipette jaugée(mL). Prélever un mL de la solution mère à l'aide d'une pipette jaugée de 1 mL + pipeteur. Verser dans la fiole jaugée de 1 L puis compléter avec une pissette d'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène.
Titrage acido-basique : on réalise un
titrage pH-métrique de v1 = 20,0 mL de
solution S1 par une solution d'acide
chlorhydrique (H3O+ ; Cl-)
de concentration cA= 1,50 10-2
mol/L. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoéchiométriques. Etablir la relation à
l'équivalence entre c1, V1,
cA et VE. d'après les coefficients de l'équation : n(NH3) équi = n( H3O+) équi soit c1V1= cAVE. c1= cAVE/V1=1,5 10-2 *14,3 / 20 = 1,07 10-2 mol/L. en
conséquence c0 = 1000 c1
=
10,7
mol/L
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|