|
Détermination expérimentale de la dureté d'une eau minérale ; précipitation de l'hydroxyde de magnésium concours technicien laboratoire 2008 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||
| .
. |
|||||||
|
|||||||
|
un degré correspond à une concentration molaire totale en ions Mg2+ et Ca2+ de 1,0 10-4 mol/L. L'étiquette d'une bouteille d'eau minérale présennte les indications suivantes : Mg2+ : 84 mg/L ; Ca2+ 486 mg/L. Déterminer la dureté de cette eau. Mg : 24,3 g/mol ; Ca : 40,1 g/mol. Quantité de matière (mol) = masse (g) / masse molaire (g/mol) n(Mg2+) = 84 10-3/24,3 = 3,457 10-3 mol ; n(Ca2+) = 486 10-3/24,3 = 1,212 10-2 mol ; n(Mg2+) +n(Ca2+) =1,56 10-2 mol dans 1 L = 156 10-4 mol dans 1 L~1,6 102 degrés.
Les réactions supports du titrage sont
: Ca2+ + Y4-
=CaY2-. Mg2+ + Y4-
=MgY2-. Elles s'effectuent simultanément.
Le protocole fourni aux élèves est le suivant : Introduire un volume v0 = 10,0 mL d'eau minérale dans un becher. Ajouter 20 mL de tampon amoniacal, ajouter quelques gouttes de NET. Doser par la solution d'EDTA à la concentration ce = 0,010 mol/L. Dresser la liste du matériel dont un élève aurait besoin pour réaliser le titrage. Pipette jaugée de 10,0 mL + pipeteur , pipette graduée de 20 mL , burette graduée, becher, agitateur magnétique. Déterminer la relation entre le volume de solution d'EDTA versé à l'équivalence (ve), sa concentration (ce), le volume v0 et la concentration totale en ions Mg2+ et Ca2+, notée c0. A l'équivalence les quantités de matière des réactifs sont en propotions stoechiométriques : vece = v0c0. Quel est le volume équivalent attendu par les élèves compte tenu des indications portées sur l'étiquette ? ve = v0c0 / ce acec c0 =1,56 10-2 mol/L ; v0= 10 mL et ce=0,010 mol/L ve =10*1,56 10-2/0,010 = 15,6 mL. Précipitation de l'hydroxyde de magnésium Mg(OH)2. le magnésium put être extrait de l'eau de mer sous forme d'hydroxyde de magnésium Mg(OH)2 (s). Les ions hydroxyde réagissent avec les ions Mg2+ pour former Mg(OH)2 (s). Ecrire l'équation correspondante. Mg2+(aq) + 2HO-(aq) = Mg(OH)2 (s). La constante de cette réaction est notée K° et vaut 1,4 1011 à 25°C. Dans 1,0 L d'eau, on introduit 2,00 10-4 mol d'ion Mg2+ (sous forme de MgCl2(s)) et 1,00 10-3 mol d'ion HO- ( sous forme de NaOH). On admet que la dissolution de MgCl2 et de NaOH est totale. Définir la grandeur Qr appelé quotient de réaction et donner sa valeur initiale. Qr = 1/([Mg2+][HO-]2) ; Qr , i = 1/([Mg2+] i[HO-] i2) =1/(2 10-4 *10-6) = 5 109. Observe t-on la formation d'hydroxyde de magnésium solide ? Justifier. Qr , i < K°, l'équilibre est déplacé dans le sens direct, précipitation de l'hydroxyde de magnésium. On considère une solution dans laquelle la concentration en ion Mg2+ est initialement de 5,0 10-2 mol/L. On en fait varier le pH par addition d'une solution d'hydroxyde de sodium suffisamment concentrée pour négliger l'effet de dilution. On fait ainsi précipiter 90 % des ions Mg2+ sous forme de Mg(OH)2 (s). Quelle est la concentration des ions Mg2+ restants alors en solution ? Il ne reste que 10 % des ions initiaux. Le volume varie peu et peut être considéré comme constant. [Mg2+]éq = 5,0 10-3 mol/L. En déduire la concentration en ions hydroxyde de cette solution. Mg2+(aq) + 2HO-(aq) = Mg(OH)2 (s). K°= 1/([Mg2+] éq[HO-] éq2) = 1,4 1011. [HO-] éq2=1/([Mg2+] éqK°) = 1/(5 10-3*1,4 1011) =1,43 10-9 ; [HO-] éq=3,8 10-5 mol/L. Quel est le pH de cette solution ? [H3O+]= 10-14 / 3,8 10-5 =2,6 10-10 mol/L ; pH = - log [H3O+] = -log2,6 10-10 =9,6.
Dosage conductimétrique d'une solution de chlorure de magnésium. V0= 20,0 mL d'une solution de chlorure de magnésium à une concentration inconue c0, sont dosés par une solution d'hydroxyde de sodium de concentration cb=0,100 mol/L. Le dosage est suivi par conductimétrie. Décrire la cellule de conductimétrie. L'extrémité de la sonde du conductimètre comporte une "lucarne", deux faces parallèles de surface S, distantes de d. On mesure la résistance électrique de la portion de solution située dans cette lucarne : l'appareil indique soit la conductance G ( S), soit la conductivité s(S m-1) de la solution. Donner la relation entre conductance et conductivité. Constante de la sonde de mesure k = d/S avec d (m) ; S (m2) et k (m-1). s = k G. On admet que le minimum de la courbe obtenue correspond à l'équivalence. Exploiter la courbe pour en déduire c0.
Mg2+(aq) + 2HO-(aq) = Mg(OH)2 (s). A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques : n(HO-)=2n(Mg2+) ; cbvéq = 2 V0c0 ; c0 =cbvéq / (2 V0) = 0,1*10/40 =0,025 mol/L.
|
|||||||
|
|
|||||||
|
|
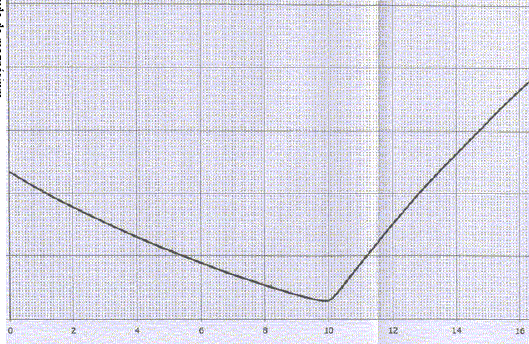 véq = 10 mL d'hydroxyde de sodium
véq = 10 mL d'hydroxyde de sodium