|
Magnésium : du minerai au métal , le magnésium en chimie organique concours technicien laboratoire 2008 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||||
| .
. |
|||||||||
|
|||||||||
|
Que peut-on en déduire sur la composition de l'atome de magnésium ? 12 électrons et 12 protons positifs. Il existe plusieurs isotopes du magnésium, notés 2412Mg, 2512Mg, 2612Mg. Qu'appelle t-on isotopes ? Des isotopes ne se différentient que par leurs nombres de neutrons ; ils ont le même numéro atomique. Donner la structure ( nombre de protons, neutrons, électrons) des trois isotopes du magnésium. 2412Mg : 12 électrons, 12 protons, 24-12 = 12 neutrons. 2512Mg : 12 électrons, 12 protons, 25-12 = 13 neutrons. 2612Mg : 12 électrons, 12 protons, 26-12 = 14 neutrons. 2412Mg : 78,7 % ;
2512Mg : 10,1 % ;
2612Mg :11,2 %. En déduire la
masse molaire du magnésium
naturel. M = 24*0,787 + 25*0,101
+26*0,112
=18,88+2,525+2,912=24,3
g/mol.
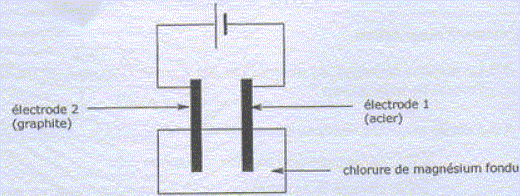
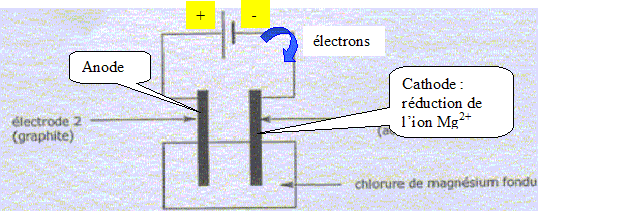
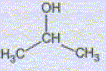
Préparation du magnésium à partir de MgCO3. MgCO3 est un solide ionique constitué d'ion Mg2+ et CO32-. Quel est le nom e l'ion CO32-. carbonate. MgCO3 subit une réaction de calcination qui forme MgO ( dolomie), MgO est ensuite réduit en Mg par le silicium Si. Cette raction forme également de la silice SiO2. Ecrire l'quation bilan de cette dernière réaction. 2MgO + Si = SiO2+2Mg Pourquoi parle t-on de réduction de MgO en Mg ? Le nombre d'oxydation du magnésium dans MgO est +II ; il est de zéro dans Mg. Le nombre d'oxydation du magnésium diminue de +II à zéro. MgO suit donc une réduction. Utilisation du magnésium en synthèse organique. Etude du composé de départ : A quelle famille chimique
appartient le composé A dont la formule
semi-développée
est : Alcool secondaire : propan-2-ol. Les pictogrammes suivants sont
présents sur les bouteilles de A : Préciser leur signification. Substance inflammable ; substance nocive, irritante. Quelles précautions faut-il prendre lors de l'utilisation de ce produit ? Travailler en absence de flamme, port de blouse, de gants et utiliser une hotte aspirante. Le propan-1-ol, noté A' est un isomère de A. Définir le terme isomère. Deux isomères ont la même formule brute mais des formules développées spatiales différentes. Qu'obtient-on par oxydation, en présence d'ions permanganate de A ? de A' ? Donner les formules semi-développées et les noms des molécules obtenues. L'alcool secondaire A conduit à une cétone H3C-CO-CH3, propanone ou acétone. L'alcool primaire A' conduit à un aldehyde CH3-CH2-CHO propanal puis à un acide carboxylique CH3-CH2-COOH acide propanoïque.
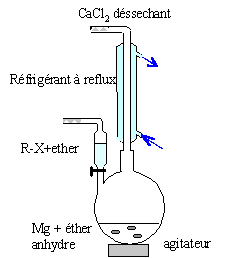
Préparation d'un dérivé halogéné. On fait réagir une solution aqueuse d'acide chlorhydrique sur le composé A. On obtient un composé B de formule brute C3H7Cl. Ecrire l'équation de cette réaction. CH3-CH(OH)-CH3 + HCl = CH3-CHCl-CH3 + H2O. Choisir parmi les termes suivants, ceux qui s'appliquent à cette réaction : addition, réduction, élimination, substitution, radicalzire, électrophile, oxydation, nucléophile. Substitution nucléophile. Nommer le composé B obtenu. 2-chloropropane. Préparation d'un organomagnésien. On introduit 4,00 g de B dans 40 mL d'ether diéthylique. On verse cette solution goute à goutte sur 2,00 g de magnésium ( sous forme de tournures) dans l'éther. Faire un schéma annoté du montage. colonne Vigeux ou réfrigérant
droit surmonté d'un dispositif
déshydratant contenant CaCl2. ampoule de coulée ; ajout goutte à
goutte du dérivé
halogéné ballon bicol contenant de l'éther anhydre
et les copeaux de magnésium Dispositif d'agitation Ecrire l'équation de la réaction de formation de l'organomagnésien. CH3-CHCl-CH3 + Mg = (CH3)2CH MgCl. Nommer l'organomagnésien. Chlorure d'isopropylmagnésium. Calculer les quantités de matière de chacun des réactifs. Cl : 35,5 ; C : 12 ; H : 1 ; Mg : 24,3 g/mol. n(Mg) = m/M = 2,00/24,3 = 8,23 10-2 mol ; n(B) = 4 / 78,5=5,10 10-2 mol. 5,10 10-2 mol de B réagit avec 5,10 10-2 mol de magnésium ; or on dispose de 8,23 10-2 mol de magnésium : ce dernier est en excès. Utiliser un excès de magnésium et ajouter le dérivé halogéné progressivement permet d'éviter une réaction parasite. Laquelle ? Réactions indésirable : réaction de couplage de Wurtz RCl + RMgCl = R-R + MgCl2 ; R est le groupe isopropyl.
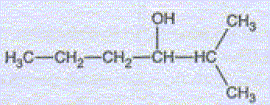
Préparation d'un alcool. l'organomagnésien précédent, noté C réagit par addition nucléophile avec le butanal pour donner, après hydrolyse l'alcool D, dont la formule semi-développée est :
Nommer l'alcool D. A quelle classe appartient-il ? 2-méthylhexan-3-ol, alcool secondaire. Ecrire l'équation des deux réactions permettant de passer de C à D. CH3-CH2-CH2-CHO + (CH3)2CH MgCl = CH3-CH2-CH2-CH (OMgCl) - CH(CH3)2. CH3-CH2-CH2-CH (OMgCl) - CH(CH3)2 + H2O = CH3-CH2-CH2-CH (OH) - CH(CH3)2 +½MgCl2 +½Mg(OH)2. Quel est l'intérêt majeur de ce type de réaction en chimie organique ? L'addition nucléophile de l'organomagnésien réduit un aldéhyde en alcool secondaire. L'alcool D est purifié par distillation fractionnée. Faire le schéma annoté du montage.
|
|||||||||
|
|
|||||||||
|
|

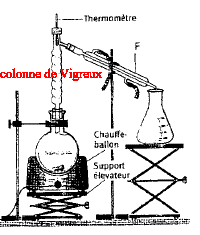 F
: réfrigérant à
eau.
F
: réfrigérant à
eau.