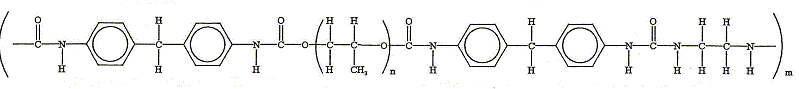|
Concours technicien police technique et scientifique 2006. pH, oxydoréduction, atomistique En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Problème 1 : Le cuivre naturel est composé de deux isotopes stables : 6329Cu et 6529Cu dont les masses atomiques sont respectivement ( en unité de masse atomique u) 62,929 et 64,927. Indiquer le nombre de protons, neutrons et électrons pour ces deux isotopes 6329Cu : 29 protons, 29 électrons et 63-29 = 34 neutrons. 6529Cu : 29 protons, 29 électrons et 65-29 = 36 neutrons. Sachant que la masse atomique du mélange isotopique est 63,540, calculer l'abondance ( en %) de chaque isotope. On note x, la fraction massique du cuivre 63 et 1-x, celle du cuivre65. 62,929 x +(1-x) 64,927 = 63,540 x = 1,389 / 1,998 = 0,695 ; 6329Cu : 69,5 % ; 6529Cu : 30,5 %.
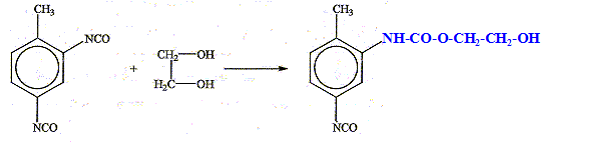
Plusieurs mécanismes de dégradation peuvent déclencher la détérioration du polyuréthane. C'est le cas de la dégradation oxydative principalement caractérisée par l'augmentation de la bande infrarouge typique du groupe CO. Par exemple les polyuréthanes, de type polyol - polyéther, commencent à se dégrader dans le segment éther du polymère, et conduisent à une scission de la chaîne polymérique et à la génération de groupes carbonyles. Après l'avoir situé dans la chaîne polymérique ci-dessous : - Donner sa formule. - Donner la suite de réactions qui conduit à l'augmentation du signal infrarouge CO.
pH. On dispose de deux solutions aqueuses, l'une solution S1 contient 1,15 10-2 mol d'acide benzoïque C6H5-COOH, dans 2,00 10-1 L ; l'autre solution S2 1,15 10-2 mol d'hydroxyde de sodium NaOH dans 1,00 10-1 L. Evaluer le pH à 298 K des solutions S1 et S2. On justifiera les approximations. pKa( C6H5-COOH / C6H5-COO-) = 4,20 La soude est une base forte, entièrement dissociée dans l'eau : pH= 14 + log cB. avec cB = 1,15 10-2/0,100 =0,115 mol/L ; pH = 14+log 0,115 =13,1. L'acide benzoïque est un acide faible peu dissocié dans l'eau.
avec [C6H5-COO- ]=[ H3O+] =xf/0,2 = 5 xf ; [C6H5-COOH] = ( 1,15 10-2-xf) / 0,2 = 5 ( 1,15 10-2-xf) 6,3 10-5 = 5 xf 2 / ( 1,15 10-2-xf) ; xf 2 +1,26 10-5xf - 1,45 10-7=0 d'où xf =3,74 10-4 mol. [ H3O+] =xf/0,2 =3,74 10-4 /0,2 =1,87 10-3 mol/L ; pH = -log(1,876 10-3) =2,72. On considère les 4 mélanges suivants :
Mélange 1 : il s'agit d'une dilution de facteur 2 : solution acide. Mélange 2 : 1,15 10-2*0,01/0,2 = 5,75 10-4 mol acide benzoïque et 1,15 10-2*0,002/0,1 = 2,3 10-4 mol de soude. La soude est en défaut, donc solution acide. Il se forme 2,3 10-4 mol d'ion benzoate et il reste 3,45 10-4 mol d'acide benzoïque : la solution possède un pouvoir tampon. Mélange 3 : 1,15 10-2*0,01/0,2 = 5,75 10-4 mol acide benzoïque et 1,15 10-2*0,005/0,1 = 5,75 10-4 mol de soude. On se trouve à l'équivalence du dosage acide benzoïque soude : la solution est une solution de benzoate de sodium ; la présence de la base faible, ion benzoate conduit à une solution basique. Mélange 4 : 1,15 10-2*0,01/0,2 = 5,75 10-4 mol acide benzoïque et 1,15 10-2*0,01/0,1 = 1,15 10-3 mol de soude. La soude est en excès de 5,75 10-4 mol, solution basique. Evaluer le pH à 298 K de ces mélanges ( on admettra les approximations usuelles vérifiées ) Mélange 1 : acide faible c= 1,15 10-2 *0,01/(0,01+0,01) = 5,75 10-3 mol/L pH=0,5(pKa-log c) = 0,5(4,2-log5,75 10-3 )=3,2. Mélange 2 : [acide benzoïque]= 3,45 10-4 / 0,02 =1,72 10-2 mol/L ; [ion benzoate]= 2,43 10-4 / 0,02 =1,21 10-2 mol/L Le couple acide benzoïque/ ion benzoate fixe le pH : pH = 4,2 + log (1,21/1,72) = 4,1. Mélange 3 : équivalence dosage acide faible base forte. La réaction prépondérante est : A- + H2O = AH + HO- constante K ; (1) avec A- ion benzoate. HO- + H3O+ = 2H2O ; constante 1/Ke ; ( 2) (1)+(2) donne : A- + H3O+ =AH +H2O constante 1/Ka d'où 1/Ka = K/ Ke soit K = Ke/Ka = 10-9,8. De plus K = [AH][HO-]/[A-] avec [AH]= [HO-] et [A-] ~5,75 10-4 /0,02 =0,0287 mol/L 10-9,8 = [HO-]2/0,0287 ; [HO-] = 2,1 10-6 mol/L ; [H3O+] =10-14/ 2,1 10-6 =4,7 10-9 ; pH =8,3. Mélange 4 : [HO-]=5,75 10-4 / 0,02 = 0,0287 mol/L [H3O+] =10-14/0,0287 =3,5 10-13 mol/L ; pH=12,5.
Equilibre de précipitation : On veut éliminer un calcul rénal fait exclusivement d'oxalate de calcium ( CaOX), de masse m = 0,768 g soit 6 10-3 mol ( CaOX). Le produit de solubilité de l'oxalate de calcium est égal à 37°C à 3,6 10-9. Quel est le volume minimum d'eau pure ( en L) néccessaire pour dissoudre complètement le calcul ? Ks = [Ca2+][OX2-] = s2 d'où s = (3,6 10-9)½ =6 10-5 mol/L Volume d'eau : 6 10-3 /6 10-5 = 100 L. L'oxalate sera t-il plus soluble dans l'eau contenant des ions Ca2+ que dans l'eau pure ? Justifier. OX représente l'ion oxalate -OOC-COO-. [Ca2+]total = s + [Ca2+]eau = s1 avec s1 > s ; [OX2-] =Ks / s1. [OX2-] est inférieure à la valeur précédente : la solubilité va donc diminuer ( effet d'ion commun).
Oxydoréduction. Déterminer les nombres d'oxydation des divers éléments, écrire les demi-équations électroniques et indiquer les espèces jouant le rôle de réducteur et d'oxydant dans les cas suivants : MnO4- et AsO33- ( couples MnO4- /MnO2 ; AsO43- /AsO33- ; MnO4- /Mn2+ ) n.o (Mn) dans MnO4- : n.o (Mn) -4*2 = -1 ; n.o (Mn) = +VII. n.o (Mn) dans MnO2 : n.o (Mn) -2*2 =0 ; n.o (Mn) = +IV. n.o (Mn) dans Mn2+ : n.o (Mn) = +II. n.o (As) dans AsO43- : n.o (As) -4*2 = -3 ; n.o (As) = +V. n.o (As) dans AsO33- : n.o (As) -3*2 = -3 ; n.o (As) = +III. couple ( MnO4- /MnO2) : MnO4- , l'oxydant se réduit. MnO4- + 4H+ + 3e- = MnO2+ 2H2O. couple ( MnO4- /Mn2+) : MnO4- , l'oxydant se réduit. MnO4- + 8H+ + 5e- = Mn2+ + 4H2O. couple (AsO43- /AsO33- ) AsO43- /, l'oxydant se réduit. AsO43- + 2H+ + 2e- = AsO33- +H2O Ecrire l'équation d'oxydoréduction suivante ( réaction de la liqueur de Fehling sur les aldehydes) CH3CHO et Cu2+ en milieu basique conduisant à Cu2O et CH3COO-. CH3CHO +3HO- = CH3COO- + 2e- + 2H2O 2 Cu2+ + 2e- + 2HO- = Cu2O + H2O CH3CHO +5HO- +2 Cu2+ = CH3COO- + Cu2O + 3H2O Déterminer les coefficients a, b, c, d, e et f des équations bilan : Cr2O72- +14H+ + b Fe2+ = c Cr3+ + d Fe3+ + 7H2O Cr2O72- +14H+ + 6 Fe2+ = 2 Cr3+ + 6 Fe3++ 7H2O K2Cr2O7+ b HBr = c BrO3 + d KBr + eBr2 + f H2O. K2Cr2O7+ 14 HBr = 2 CrBr3 + 2 KBr + 3 Br2 +7 H2O.
Le dosage de l'alcool éthylique dans le sang s'effectue selon le mode opératoire suivant : après prise de sang, on oxyde l'éthanol C2H5OH en acide acétique CH3-COOH par un excès de dichromate de potassium K2Cr2O7 en milieu acide. Le bichromate de potassium restant dans la solution est dosé par une solution d'iodure de potassium KI. Ecrire les différentes équations d'oxydoréduction. équation de la réaction entre les ions dichromate et l'éthanol : 2 fois { Cr2O72- + 14 H+ + 6 e- = 2 Cr3++7 H2O } 3 fois { CH3-CH2OH +H2O = CH3-COOH + 4e- + 4H+} 2 Cr2O72- + 16 H+ + 3 CH3-CH2OH = 4 Cr3++ 11H2O + 3 CH3-COOH équation de la réaction entre les ions dichromate et iodure : Cr2O72- + 14 H+ + 6 e- = 2 Cr3++7 H2O 3 fois {2I- = I2 + 2e- } Cr2O72- + 14 H+ + 6 I- = 2 Cr3++7 H2O + 3I2. Le processus expérimental décrit correspond-il bien au sens d'évolution spontanée ( dans les conditions standards) des réactions sachant que : CH3-COOH /C2H5OH : E1 = 0,11 V ; I2/I- : E2 = 0,54 V ; Cr2O72- / Cr3+ : E3 = 1,33 V. Cr2O72- , oxydant plus fort et C2H5OH réducteur le plus fort ( oxydation spontanée de l'éthanol par l'ion dichromate) Cr2O72- , oxydant plus fort et I- réducteur le plus fort ( oxydation spontanée de l'ion iodure par l'ion dichromate). On isole la quantité d'éthanol contenue dans 5 mL de sang prélevé après un alcootest positif et on l'introduit dans 100 mL ( on néglige l'augmentation de volume due aux 5 mL) d'une solution acide de K2Cr2O7 à 1,38 10-2 mol/L. Quel est la teneur en alcool de ce sang ( g/L), sachant que l'on utilise 9 mL d'une solution de KI 0,83 mol/L pour doser le dichromate en excès ? Conclure. Nombre de moles de
Cr2O72-
utilisé pour l'oxydation de l'éthanol
: Quantité de matière initiale d'ion dichromate : 0,1*1,38 10-2= 1,38 10-3 mol. Quantité de matière d'ion dichromate utile pour oxyder l'éthanol :(1,38-1,245) 10-3=1,35 10-4 mol. Concentration massique en g/L de l'éthanol :
[alcool] = 2,025 10-4 / 0,005 =4,05
10-2 mol/L |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|