|
électrolyse, cinétique, catalyse, corps gras, absorbance. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts concours kiné St Michel 2008. |
|||||||
| .
. |
|||||||
|
|||||||
|
Texte : Par le procédé à anode soluble, on purifie une lame d'aluminium impur, contenant des impuretés inoxydables. Le bain d'électrolyse contient du nitrate d'aluminium et la cathode est en carbone. L'équation de fonctionnement est : Al(s) + Al3+aq = Al(s) + Al3+aq. A. La variation de masse de la cathode est positive. ( vrai ) réduction des ions Al3+aq en Al(s) à la cathode ; dépôt métallique d'aluminium sur le carbone. B. La concentration en ion Al3+aq reste globalement stable au cours de l'électrolyse. ( vrai ) A la cathode négative : Al3+aq + 3e- = Al(s) ; à l'anode positive : Al(s) =Al3+aq + 3e- . C. L'anode de l'électrolyseur, de pôle négatif, ubit une oxydation. L'anode est reliée à la borne positive du générateur. D. La transformation chimique de cette électrolyse est naturelle. L'électrolyse est une transformation forcée ; elle nécessite l'apport d'énergie sous forme électrique. E. Les ions nitrates se déplacent dans le sens du courant, dans le bain d'électrolyse. Les ions nitrates, négatifs se déplacent en sens contraire du courant. Texte : l'intensité ayant parcouru le circuit dans cette électrolyse est : 37 dA ; 300 dA ; 333 cA ; 30 A ; 333 dA. Données : masse d'anode traitée : m=30 g ; M(Al)= 27 g/mol ; % impuretés 10 % en masse ; durée de l'électrolyse Dt = 9650 s. masse des impuretés : 30*0,1 = 3 g ;
masse d'aluminium traitée 27 g soit 1
mol. Al(s)
=Al3+aq + 3e-
. Donc 3 mol
d'électrons soit 96500*3
coulombs. De plus la quantité
d'électricité est : Q = I
Dt
= 96500*3 = 9650 I I = 30
A=
300
dA.
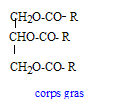
Corps gras. Un corps gras E est obtenu à partir de propane-1, 2, 3-triol et d'acide oléique suivant une réaction (1). Le corps E est ensuite traité par une solution de diiode, suivant une réaction d'addition (2), en donnant le corps D. Donnée : acide oléique :C17H33COOH. A. Le corps E est un trialcool. E est un triester du glycérol. B. La réaction (1) est lente et limitée. ( vrai ). C. La réaction (2) permet de caractériser les corps gras à chaînes insaturées. (vrai) D. Le corps D possède 6 atomes d'iode dans sa formule brute. (vrai) E. L Le corps E est un tricarbonate de glycérile. formule semi-développée acide oléique : CH3-(CH2)7-CH=CH-(CH2)7-COOH formule des corps gras formés entre le
glycérol et l’acide oléique : l'acide
oléique est noté R-COOH addition de 3 moles de diiode ( par mole de corps gras) sur les trois doubles liaisons carbone carbone des trois chaînes carbonnées R R devient alors : CH3-(CH2)7-CH I-CH I-(CH2)7-
Texte : un monoalcool A réagit avec l'ion permanganate en milieu acide, en donnant un corps organique suivant une réaction (1). Le corps B réagit sur le réactif de Tollens suivant une réaction (2). Le corps A réagit avec du chlorure d'hydrogène suivant une réaction (3) en donnant entre autres le corps organique D. A. Dans la réaction (1) l'alcool est réduit par l'ion paermanganate. L'alcool est oxydé, l'ion permanganate est réduit. B. Le réactif de Tollens met en évidence les propriétés oxydantes de B dans la réaction (2). Le test positif au réactif de Tollens met en évidence les propriétés réductrices des aldehydes. C. La réaction (3) est une réaction de substitution. ( vrai ) D. Le corps D peut être obtenu par reformage catalytique. E. Le réactif de Tollens est une solution de nitrate d'argent alcoolique. " nitrate d'argent ammoniacal".
Spectrophotométrie. A. La couleur observée d'une solution est la couleur absorbée par la solution. La couleur observée d'une solution est la couleur complémentaire de la couleur absorbée par la solution. B. Les radiations constituant la lumière visible ont des longueurs d'onde se situant entre 400 et 800 mm. entre 400 et 800 nm. C. L'absorbance d'une solution varie avec la longueur de la cellule spectrophotométrique. ( vrai ) D. Le coefficient d'extinction molaire d'un corps varie avec la longueur de la cellule. E. L'absorbance de deux solutions colorées est toujours la somme de leur absorbance. Si une solution contient plusieurs solutés absorbants la lumière, l'absorbance de la solution est égale à la somme des absorbances de chacun des solutés. soluté 1 et soluté 2 dans la même solution.
|
|||||||
|
|
|||||||
|
|