|
Culture générale, écholocation, spectrophotométrie : diiode concours ingénieur Geipi 2008 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
|
En octobre 2007, l’académie des Nobel a décerné le prix de physique à Albert Felt et Peter Grünberg. Leurs travaux ont mis en évidence le phénomène de magnétorésistance géante. A quel champ disciplinaire de la physique cette étude fait-elle partie ? astronomie ; énergétique; nano sciences ; étude du climat ; physique nucléaire. Cette découverte trouva rapidement une application dans l’augmentation importante de la capacité de stockage des disques durs. Donnez la signification de l’acronyme GPL. Gaz de pétrole liquéfié. Quels sont les alcanes présents majoritairement dans le GPL ? méthane ; propane et butane ; hexane ; octane ; décane. Donnez la formule brute du bio éthanol. C2H5OH. Sa production est actuellement controversée. Donnez 2 arguments en faveur de son emploi et 2 arguments en sa défaveur. Pour : la combustion du bioétanol libère le CO2 absorbé par la plante : cela n'aggrave pas l'effet de serre. Energie renouvelable. Contre : les plantes utilisées dans la production de bioétanol ne peuvent plus l'être pour la consommation humaine, d'où l'augmentation du prix des denrées alimentaires. Il faudrait utiliser toute la plante et non pas seulement la graine et améliorer le bilan énergétique. Quel physicien a donné son nom aux lois régissant le mouvement des planètes autour du Soleil ? Kepler. Compléter la phrase : La
seconde
est la durée de 9 192 631 770
périodes de la radiation correspondant
à la transition entre 2 niveaux hyperfins de
l’état fondamental de l’atome de
césium 133.
Chauves-souris et mammifères marins émettent aussi des sons perceptibles par l'homme. Ces "cris" servent à la communication sociale. A quelle gamme de frequence appartiennent-ils ? les fréquences audibles pour l'oreille humaine s'étendent de 20 Hz à 20 kHz. Un son de fréquence 8 kHz a une longueur d'onde lair = 4,25 cm lorsqu'il se propage dans l'air, et une longueur d'onde leau = 18,75 cm lorsqu'il se propage dans l'eau saline. Déterminer la célérité du son dans chacun de ces milieux. la fréquence est une caractéristique d'une onde : elle reste la même que que soit le milieu de propagation. cair = lair f = 4,25 10-2 *8000 =3,4 102 m/s. ceau = leau f = 18,75 10-2 *8000 =1,5 103 m/s. Quelle propriété des milieux est mise en évidence lorsque l'on compare les valeurs trouvées à celles de la célérité des ultrasons dans l'air et l'eau de mer ? Ces milieux ne sont pas dispersifs : la
célérité ne dépend pas de la
fréquence.
En milieu acide, le peroxyde d’hydrogène réagit avec les ions iodure. L’étude expérimentale montre que la réaction est totale, lente, et permet d’obtenir une mole de diiode (I2) par mole de peroxyde d’hydrogène consommée. Ecrire pour chacun des couples (H2O2/H2O) et (I2/I-) la demi-équation d’oxydoréduction associée. H2O2+2H++ 2e- =2H2O réduction 2I- = I2 + 2e-, oxydation. On se propose d’étudier la cinétique de cette réaction. Pour ce faire, on mélange à l’instant initial les solutions suivantes : - 50 mL d’iodure de potassium de concentration 0,02 mol/L - 100 mL d’acide sulfurique (H2SO4) de concentration 0,05 mol/L - 50 mL de peroxyde d’hydrogène de concentration 0,02 mol/L Ecrire l’équation-bilan de la réaction du peroxyde d’hydrogène sur l’iodure de potassium. H2O2+2H++2I- = I2 +2H2O. Dans cette réaction, quelle est l’espèce chimique oxydante ? L’espèce réductrice ? H2O2 joue le rôle d'oxyant, I- celui de réducteur. Calculer la quantité minimale de peroxyde d’hydrogène nécessaire pour oxyder tout l’iodure. Quel est le réactif limitant ? Quantité de matière initiale : n(I-) = 0,05*0,02 = 10-3 mol ; n(H2O2) =
0,05*0,02 = 10-3 mol ; n(H+) =0,1*0,05
= 5 10-3 mol Si H2O2 est en défaut : 10-3-xmax =0 ; xmax =10-3. L'ion iodure est le réactif limitant. Il faut 5 10-4 mol de H2O2 pour oxyder tous les ions iodures.
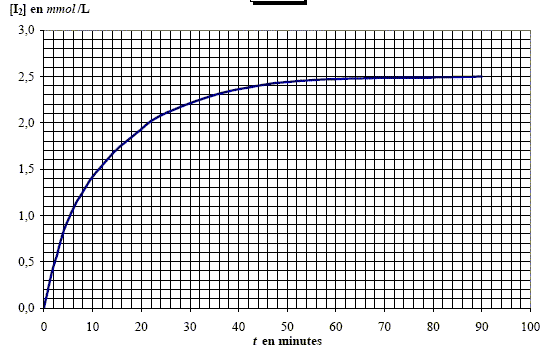
La spectroscopie visible permet de suivre l’évolution de la réaction, le diiode étant la seule espèce absorbante, ce qui permet d’établir la variation de [I2] en fonction du temps
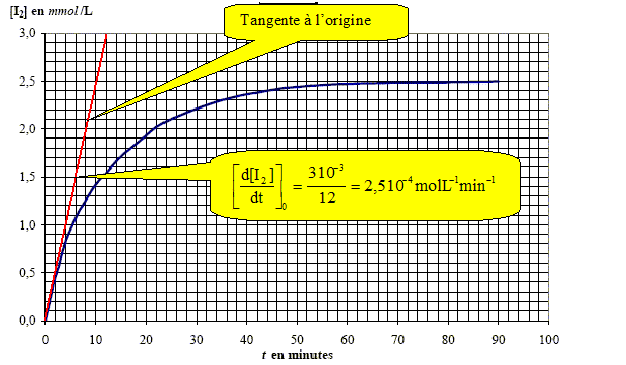
A partir des données, déterminer la vitesse volumique initiale : v0 .
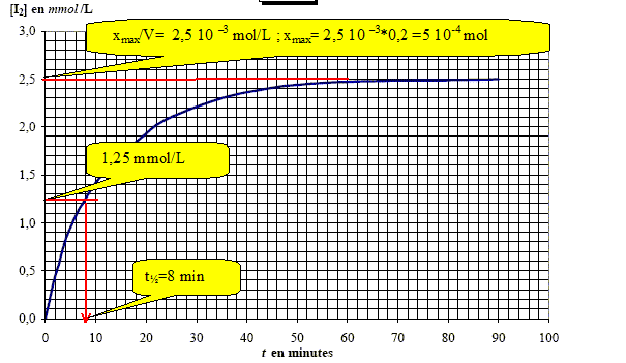
Déterminer le temps de demi-réaction : t½.
Sachant que le diiode apparaît jaune-orangé, choisir parmi les longueurs d’onde celle qui est la mieux adaptée à la mesure de sa concentration par spectrophotométrie visible. 5560 nm ; 212 nm ; 32 nm ; 7896 nm ; 415 nm. La couleur absorbée est la couleur complémentaire de la teinte de la solution. La teinte complémentaire du jaune orangé est le bleu d'où : 415 nm. |
|||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||
|
|