|
Elément chlore ; synthèse d'un alkyl-phénol ; pHmétie ; conductimétrie concours contröleur répression des fraudes 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
Le chlore (Z=17) est situé à la 17è colonne de la classification périodique. Comment s'appelle cette colonne ? Halogènes. Que représente Z ? Nombre de charge ; numéro atomique. Combien d'électrons de valence possède le chlore ? Donner sa représentation de Lewis. 7 électrons de valence. Le corps simple chlore dans les conditions standard est sous forme de dichlore Cl2. Proposer une explication. Règle de l'octet : un atome à tendance à compléter à huit sa couche électronique externe.
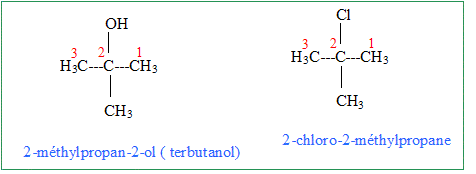
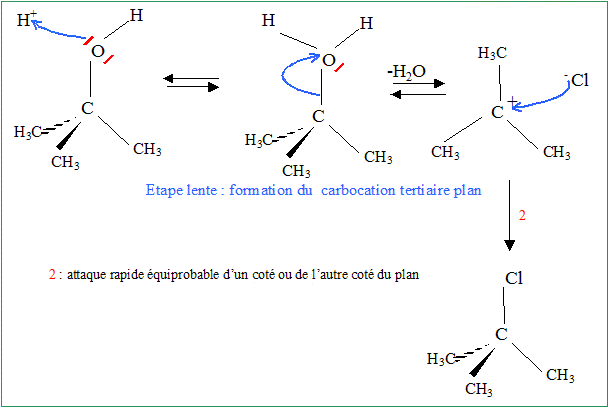
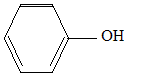
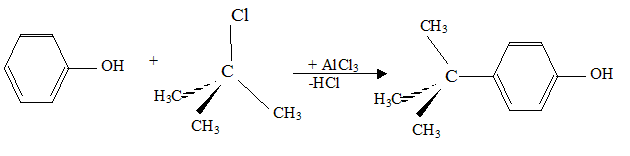
On mélange 10 mL de de C(CH3)3OH, 30 mL d'acide chlorhydrique concentrée et 4 g de CaCl2. Après purification par distillation, on obtient 6,5 mL de C(CH3)3Cl. Expliquer brièvement sur quel principe repose la distillation. En chauffant un mélange, le produit le plus volatil s'évapore en premier. Est-il nécessaire d'effectuer une distillation fractionnée ? Justifier. Non : le produit de la réaction est le plus volatil : les réactifs disparaissent : le résidu de la distillation est une solution d'acide chlorhydrique utilisé en excès. Calculer le rendement R1 de la synthèse de C(CH3)3Cl. densite : d(C(CH3)3OH) = 0,81 ; d(C(CH3)3Cl) = 0,85. C(CH3)3OH : masse 10*0,81 = 8,1 g ; masse molaire : 74 g/mol ; n = 8,1/74 =0,11 mol acide chlorhydrique concentré : en excès On peut théoriquement obtenir 0,11 mol de C(CH3)3Cl. C(CH3)3Cl : M = 92,5 g/mol ; m = nM = 0,11*92,5 = 10,2 g ; volume : m/d = 10,2/0,85 =12 mL rendement : volume réel / volume théorique = 6,5/12 = 0,541 ( 54 %) On fait maintenant réagir les 6,5 mL de C(CH3)3Cl juste synthétisés sur 4 g de phénol (C6H5OH) dissout dans 45 mL de dichlorométhane. On ajoute ensuite 0,2 g de chlorure d'aluminium(III). Donner la formule
développée du
phénol. Sur le flacon contenant le phénol, on voit écrit R 24/25-34, S 28-6-45. À quoi cela fait-il référence ? Risque : éviter tout contact avec la peau et les yeux. mesures de Sécurité à prendre. Écrire l'équation bilan de la réaction. De quel grand type de réaction s'agit-il ? Donner le nom de cette réaction.
Substitution électrophile sur le noyau benzénique : acylation de Friedel et Crafts. Quel est le rôle d'AlCl3 ? Catalyseur.
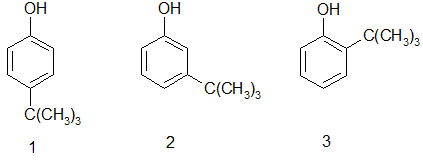
Après avoir nommé ces trois composés, expliquer en justifiant et en nommant les règles utilisées lequel sera le produit le majoritaire ? 1 : 4-terbutylphénol (p) terbutylphénol ; 2 : 3-terbutylphénol (m) terbutylphénol ; 3 : 2-terbutylphénol (o) terbutylphénol. 1 est majoritaire : le groupe OH, donneur, renforce la densité électronique sur les positions ortho et para. Le groupe tertbutyle est volumineux : la position ortho est défavorisée, emcombrement stérique.
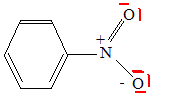
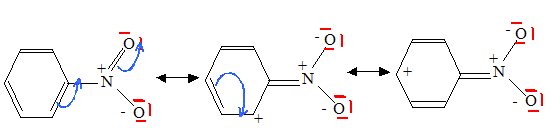
Écrire la représentation de Lewis du nitrobenzène C6H5NO2.
Quel produit majoritaire aurait-on obtenu si on était parti du nitrobenzène ? Justifier. Le groupe nitro, accepteur d'électrons, diminue la densité électronique du noyau benzénique : la position méta est la moins affectée. La sustitution s'effectue donc en position méta.
Après avoir effectué différents lavages et après purification, on obtient 5,50 g de produit pur. C10H14O : température fusion : 95 - 98°C ; température ébullition : 239°C Sous quel état physique se trouve ce produit ? Solide. Quelle méthode de purification a pu être mise en œuvre ? Recristallisation. Calculer le rendement R2 de cette deuxième partie de synthèse. C(CH3)3Cl : M = 92,5 g/mol ; v = 6,5 mL ; m = 6,5 *0,85= 5,53 g ; n=m/M =5,53 /92,5 =0,060 mol. phénol : M = 94 g/mol ; n=m/M = 4/94 = 4,25 10-2 mol ( en défaut) On peut donc obtenir au mieux 4,25 10-2 mol de produit. masse molaire C10H14O : M = 150 g/mol ; mthéorique = 4,25 10-2 *150 = 6,37 g R2 = 5,5/6,37 = 0,863 ( 86 %) par rapport au réactif en défaut. Calculer le rendement R global de la synthèse. R=R1 R2 = 0,541*0,863 =0,467 (47 %) pH-métrie. Lors de la réaction de C(CH3)3Cl sur le phénol, il se dégage des vapeurs de chlorure d'hydrogène. On admettra pour cette partie que pour une mole de phénol consommée, une mole de chlorure d'hydrogène est formée. Ces vapeurs sont dirigées et piégées dans un becher contenant de la soude. Pour faire la réaction, on a mélangé 6,5 mL de C(CH3)3Cl et 4 g de phénol (C6H5OH). M( C(CH3)3Cl) = 92,57 g/mol ; M(phénol) = 94,11 g/mol En considérant un rendement de 100%, quelle quantité (en mol) de chlorure d'hydrogène doit se dégager ? C(CH3)3Cl : M = 92,5 g/mol ; v = 6,5 mL ; m = 6,5 *0,85= 5,53 g ; n=m/M =5,53 /92,5 =0,060 mol. phénol : M = 94 g/mol ; n=m/M = 4/94 = 4,25 10-2 mol ( en défaut) donc n(HCl) = 4,25 10-2 mol. Si on souhaite placer 150 mL de soude dans le bécher pour détruire toutes les vapeurs d'acide, quelle est la concentration minimale que doit avoir la soude ? HCl + HO- = H2O + Cl-. n(HO-) = n(HCl )= 4,25 10-2 mol ; n(HO-) = Cv = 0,15 C ; Cminimale = 4,25 10-2 /0,15 =0,28 mol/L.
On place 100 mL de soude 0,5 mol.L-1. En fin de réaction, on récupère le bécher de soude et on se propose de la doser. Définir un indicateur coloré acido-basique. Un indicateur coloré est constitué d'un couple acide /base : la forme acide et la forme base conjuguée ont des teintes différentes. Le dosage de la soude se fait par de l'acide sulfurique à 0,6 mol.L-1. Ecrire l'équation globale du dosage. coples acide /base H3O+ / H2O ; H2O/HO-. H3O+ + HO- = 2 H2O À l'équivalence, quel est approximativement le pH de la solution ? acide fort et base forte, pHéquivalent = 7. En déduire quel indicateur coloré parmi ceux proposés peut convenir pour ce dosage.
Malheureusement, le laboratoire ne dispose pas d'indicateur coloré. Le dosage est donc suivi par pH-métrie. Le volume équivalent trouvé est Veq=14,30 mL. Quelles électrodes doit-on utiliser pour ce type de dosage ? Electrode combinée de verre ( électrode de référence + électrode de mesure ). Calculer quantité de matière de soude restant dans le bécher. En déduire la quantité de chlorure d'hydrogène effectivement dégagé. L'acide sulfurique est un diacide : [H3O+] = 2*0,6 = 1,2 mol/L n(H3O+) = 1,2 Véq =1,2 *14,3 = 17,2 mmol n(HO-) dosé, restant= n(H3O+) =17,2 mmol ; n(HO-) initial= 100*0,5 = 50 mmol n(HCl)= n(HO-) initial-n(HO-) dosé, restant =50-17,2 =32,8 mmol. Quelle est alors la valeur du rendement de la réaction entre C(CH3)3Cl et le phénol ? n(C10H14O)réel = 32,8 mmol = 3,28 10-2 mol. rendement : valeur réelle / valeur théorique = 3,28 10-2 / 4,25 10-2 = 0,77 (77 %). Comparer au rendement calculé ci-dessus. La valeur du rendement, calculé par cette méthode, est un peu plus faible 77% au lieu de 86 %. Une analyse montre que le produit obtenu est pur à 100% : d'où peut alors provenir la différence constatée ? Si la soude avait été dosée par l'acide chlorhydrique et que le suivi du dosage avait été réalisé par conductimétrie, quelle aurait été l'allure de la courbe obtenue? Justifier.
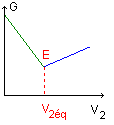
Du point de vue de la conductivité, ajouter de la soude revient à remplacer l'ion H3O+ par l'ion sodium Na+ de conductivité molaire ionique 7 fois plus faible. La conductivité s ( et la conductance G) diminue. Après l'équivalence : HO- est en excès dans l'erlenmeyer. Du point de vue de la conductivité, ajouter de la soude revient à ajouter l'ion HO- et l'ion sodium Na+. La conductivité s augmente.
|
|||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
|
|