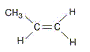|
chimie organique : eugénol, propène ; cristallographie concours technicien fraudes 05 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||||
| .
. |
|||||||||
|
|||||||||
|
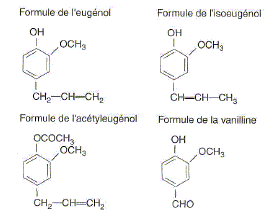
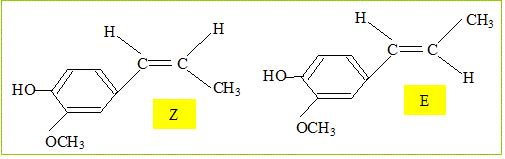
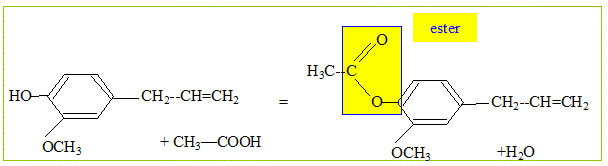
Son huile essentielle, extraite par hydrodistillation, contient également un autre composé volatil : l'acétyleugénol. L’eugénol possède un isomère (l'isoeugénol) qui, lui, a une odeur de noix demuscade. L’eugénol peut être utilisé pour l'hémisynthèse de la vanilline, constituant principal de la vanille naturelle. Quel type d'isomérie existe-t-il entre l'eugénol et l'isoeugénol ? Les fonctions chimiques sont identiques : seule la liaison éthylénique ( C=C) a changé de position. Donc isomères de position d'un fonction. L'un des composés ci-dessus présente une stéréo-isomérie. Représentez et identifiez les deux stéréo-isomères. Quel est cet acide carboxylique ? Ecrivez l'équation bilan de la réaction. acide éthanoïque CH3-COOH
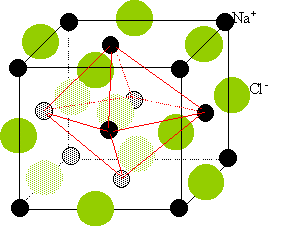
Ecrivez la réaction. CH3-CH=CH2 + H2 = CH3-CH2-CH3 . A quelle catégorie d'hydrocarbures le produit obtenu appartient-il ? alcanes Nommez ce produit. propane Cristallographie. Donnez la définition d’une maille. Parallélépipède élémentaire qui se reproduit à l'identique suivant 3 directions, caractérisé par 3 longueurs et 3 angles. Soient : r+ : rayon du cation ; r- : rayon de l’anion ; a : côté du cube que constitue la maille. Pour CsCl : r+ = 167 pm ; r- = 181 pm ; a = 402 pm. Pour NaCl : r+ = 98 pm ; r- = 181 pm ; a = 558 pm. Pour chacun des cristaux ioniques suivants : CsCl et NaCl Donnez le type de maille et la coordination. cristaux type NaCl : Deux réseaux cubiques à faces centrées, l'un d'ion Na+, l'autre d'ion chlorure Cl-. Ces réseaux se déduisent l'un de l'autre par translation parallèle aux arètes de la maille et de valeur égale à la moitié du coté de la maille. Chaque ion est au centre d'un octaèdre, entouré de 6 ions de signe opposé occupant les 6 sommets.
Localisez l’emplacement des ions dans la maille et faites-en une représentation.
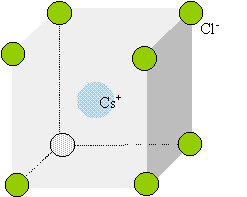
cristaux du type chlorure de césium : Le chlorure de césium : deux réseaux cubiques, déduits l'un de l'autre par une translation parallèle à une diagonale et de valeur égale à la moitié de la diagonale du cube.
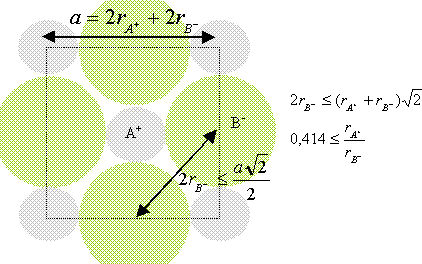
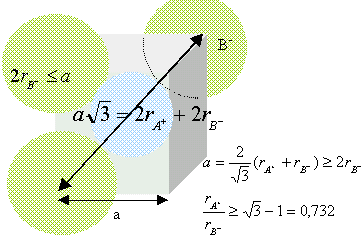
Chaque ion Cs+ est équidistant de 8 ions chlorures. Chaque ion Cl- est équidistant de huit ions Cs+. Déterminez un encadrement du rapport r+/r- en partant de la condition d’existence du cristal ionique. composé binaire AB : conditions pour que AB cristallise dans un réseau type NaCl : représentons une section de la maille, les anions étant plus gros que les cations.
Dans le cas de CsCl, le rapport des rayons ioniques est : 1,67 /1,81 =0,922 CsCl ne cristallise pas dans le type NaCl (voir ci dessus)
Calculez la compacité t du réseau cristallin. C'est le rapport du volume occupé par les ions au volume de la maille. 4 ions Na+ par maille de rayon 0,97 10-10 m. volume : 4*4 /3 *3,14 * ( 0,98 10-10)3 =1,53 10-29 m3. 4 ions Cl- par maille de rayon 1,81 10-10 m. volume : 4*4 /3 *3,14 * ( 1,81 10-10)3 =9,9 10-29 m3. volume de la maille : (5,58 10-10 )3 =1,78 10-28 m3. compacité : (1,53 10-29 + 9,9 10-29 ) / 1,78 10-28 = 0,64. 1 ion Cs+ par maille de rayon 1,67 10-10 m. volume : 1*4 /3 *3,14 * ( 1,67 10-10)3 =1,94 10-29 m3. 1 ions Cl- par maille de rayon 1,81 10-10 m. volume : 1*4 /3 *3,14 * ( 1,81 10-10)3 =2,48 10-29 m3. volume de la maille : (4,02 10-10 )3 =6,5 10-29 m3. compacité : (1,94 10-29 + 2,48 10-29 ) / 6,5 10-29 = 0,68. |
|||||||||
|
|
|||||||||
|
|