|
Concours adjoint technique principal de laboratoire interne 2008. spectrophotométrie : option
C. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
Préciser la liste du matériel nécessaire à la préparation, à partir de dichromate de potassium K2Cr2O7 pur cristallisé, 100 mL de solution de dichromate de potassium à 100 mg/L en milieu acide sulfurique dilué. Balance électronique de précision, spatule et coupelle. Fiole jaugée de 100 mL, pissette d'eau distillée, dispositif d'agitation, acide sulfurique dilué. Préciser les équipements de protection individuels nécessaires pour réaliser la pesée du dichromate de potassium. Port de gants, blouse et travail sous hotte aspirante. Préciser les équipements de protection individuels nécessaires pour préparer à partir d'acide sulfurique pur commercial, la solution d'acide sulfurique à environ 0,005 mol/L utilisé comme solvant pour la dissolution de dichromate de potassium. Port de blouse, gants et lunettes de protection. Contrôle de la solution de dichromate de potassium par dosage volumétrique.
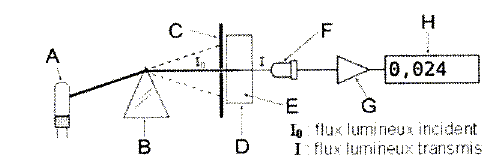
Contrôle du spectrophotomètre. Loi de beer Lambert. A = elc. Donner la signification des grandeurs utilisées dans cette loi. e est le coefficient d'extinction molaire, caractéristique de la substance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L). A est l'absorbance ou densité optique. Préciser les conditions d'application de cette loi. Cette loi est vérifiée lorsque la solution est de concentration inférieure à : c < 0,1 mol.L-1. Schéma d'un spectrophotomètre monofaisceau.
Compléter le tableau ci-dessous :
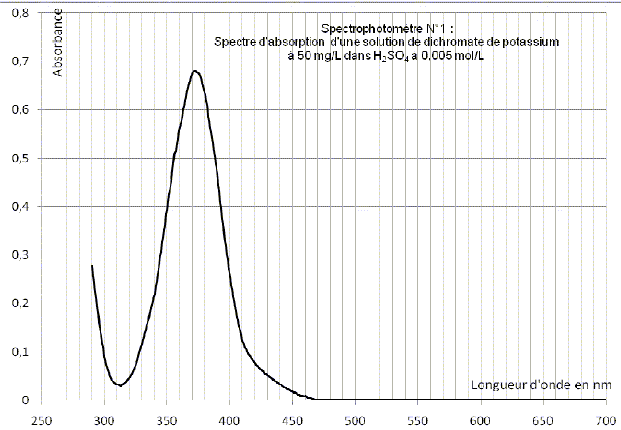
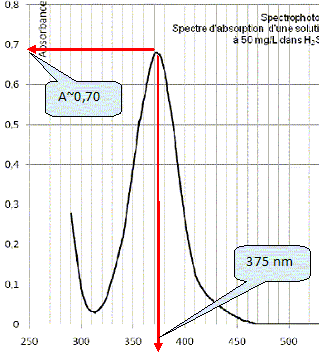
Contrôle de l'exactitude des absorbances : Ce contrôle peut être fait par des filtres, des verres neutres ou des substances en solution ( par exemple le dichromate de potassium, nitrate de nickel ) qui présentent de larges bandes d'absorption :
Conclure sur l'exactitude de ce spectrophotomètre.
Ce spectrophotomètre ne donne pas de bons résultats.
|
|||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||
|
|