|
oscilloscope, optique, solutions à préparer, pHmétrie. Concours adjoint technique principal de laboratoire externe 2008. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||||||||||||
| .
. |
|||||||||||||||||
|
|||||||||||||||||
|
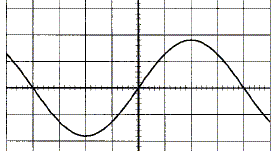
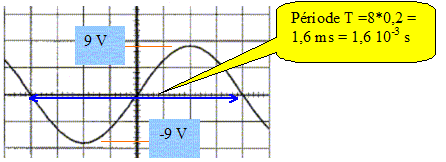
On visualise la tension aux bornes d'une lampe alimentée par un générateur basse fréquence ( GBF) en branchant un oscilloscope aux bornes de la lampe. Les réglages de l'oscilloscope sont : 5 V/div et 0,2 ms/div. On obtient l'oscillogramme suivant :
Préciser la forme, la période, la fréquence, les valeurs extrémales, la valeur efficace. Tension sinusoïdale
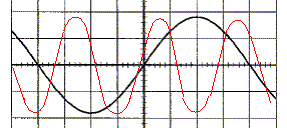
fréquence f = 1/T = 1/1,6 10-3 = 625 Hz. valeur efficace : 9/1,414 ~6,4 V. Sans modifier les réglages du GBF on change ceux de l'oscilloscope : 5 V/div et 0,5 ms/div. Tracer la nouvelle courbe obtenue. 10 divisions correspondent à 5 ms soit environ 3 périodes
Préparer des solutions. On veut préparer de deux façons différentes 100 mL de solution de chlorure de cuivre II de concentration molaire c= 0,100 mol/L Méthode n°1 : à partir de la poudre de chlorure de cuivre II anhydre de masse molaire 170,5 g/mol. Quelle masse de poudre faut-il prélever ? Quantité de matière (mol) = volume (L) * concentration (mol/L) n = CV = 0,100*0,100 = 0,0100 mol. masse (g) = quantité de matière (mol) * masse molaire (g/mol) m = 0,0100 *170,5 = 1,71 g. Quel récipient utilise t-on pour préparer cette solution ? Fiole jaugée de 100 mL. Expliquer brièvement le protocole à suivre. pesée : balance électronique au 1/100, coupelle et spatule entonoir et fiole jaugée de 100 mL contenant un peu d'eau distillée. Agiter pour dissoudre le solide et compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène. Méthode n°2 : à partir d'une solution mère de concentration Cmère = 0,500 mol/L. Quel est le nom de l'opération de chimie à réaliser pour passer de Cmère à C ? Dilution. Quel volume de solution mère faut-il prélever ? Facteur de dilution F = Cmère/C = 5. Volume de la pipette jaugée = volume de la fiole jaugée / F = 100 /5 = 20,0 mL. Détailler le protocole. Prélever 20,0 mL de solution mère à l'aide d'une pipette jaugée et pipeteur. Placer le prélevement dans la fiole jaugée de 100 mL Rincer la pipette à l'eau distillée et compléter la fiole jaugée jusqu'au trait de jauge. Agiter pour rendre homogène.
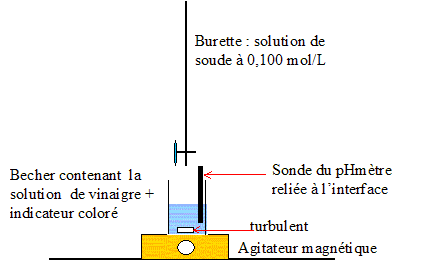
Titrage pHmétrique : Pour déterminer le degré d'acidité d'un vinaigre, on le titre par une solution d'hydroxyde de sodium ( soude) de concentration molaire C=0,100 mol/L. On mesure le pH de la solution à l'aide d'une électrode combinée, reliée à un ordinateur par l'intermédiaire d'une interface. En même temps pour des raisons pédagogique on utilise un indicateur coloré. Faire un schéma annoté du dispositif expérimental.
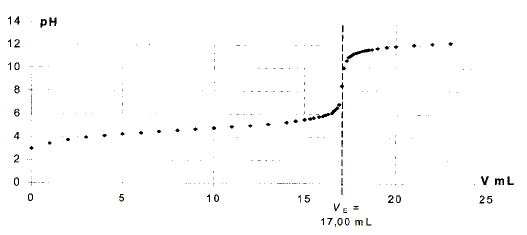
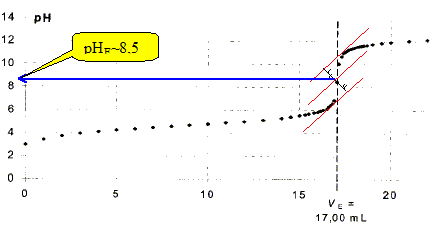
On obtient la courbe suivante :
Quel indicateur coloré, parmi la liste suivante, faut-il utiliser pour ce titrage ?
La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent : donc phénolphtaleine.
|
|||||||||||||||||
|
|
|||||||||||||||||
|
|