|
oxydoréduction, synthèse de l'aspirine. Concours manipulateur électroradiologie médicale APHP 2008. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
|
Texte : de la poudre de fer est recouverte d'une solution aqueuse de nitrate de plomb Pb2+aq +2 NO3-aq. Des ions fer (II) apparaissent en solution et du métal plomb apparaît sur la poudre de fer. A. Le fer est réduit en ion fer (II). faux. Le fer est oxydé en ion fer II : Fe(s) = Fe2+aq + 2e-. B. Les ions Pb2+ ont capté des électrons cédés par le fer. vrai. Pb2+aq + 2e- = Pb(s) C. Les couples intervenant dans cette réaction d'oxydoréduction sont Pb2+aq/Pb(s) et Fe3+aq/Fe2+aq. faux. Pb2+aq/Pb(s) et Fe2+aq/Fe(s) D. La concentration de la solution en ion Pb2+ diminue lors de cette transformation. vrai. Le vecteur accélération est centripète ; sa valeur est a=v2/R, avec R rayon du cercle.
Texte : les ions permanganate MnO4-aq du couple ( MnO4-aq / Mn2+aq) et les ions Fe2+aq du couple Fe3+aq/Fe2+aq réagissent suivant la réaction chimique d'équation : MnO4-aq + 5 Fe2+aq + 8 H3O+aq = Mn2+aq+5Fe3+aq + 12 H2O(l). vrai. MnO4-aq + Fe2+aq = Mn2+aq+Fe3+aq + 5e-. MnO4-aq + Fe2+aq + 8 H3O+aq = Mn2+aq+Fe3+aq + 12 H2O(l). MnO4-aq + Fe2+aq + 8 H+aq + 4e- = Mn2+aq+Fe3+aq + 4H2O(l).
MnO4-aq + 8
H3O+aq
+ 5e- =
Mn2+aq+12H2O(l).
réduction. 5 fois {
Fe2+aq
=
Fe3+aq
+ e-} oxydation
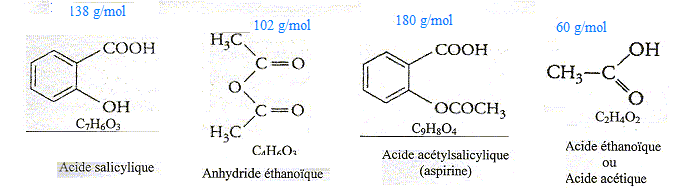
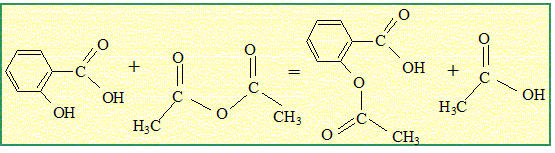
Synthèse de l'aspirine.
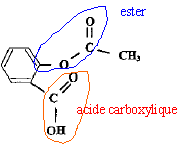
Aide aux calculs : 2*138 = 276 ; 3*102 = 306 ; 1,45*1,8 = 2,61 ; 19,6*2,61 = 51,2. 2,00/138 = 1,45 10-2 ; 3,00/102 = 2,94 10-2 ; 1,45/1,8 = 0,81 ; 19,6/2,61 = 7,51. On réalise la synthèse de l'acide acéthylsalicylique ( aspirine) par une réaction de m1 = 20,0 g d'acide salicylique et V2 = 30 ,0 mL d'anhydride acétique de masse volumique m2 = 1,00 g/mL. L'équation de la réaction est : C7H6O3 + C4H6O3 =C9H8O4 + C2H4O2 . Préciser le nom de la synthèse et préciser ces caractéristiques. Estérification d'un alcool par une anhydride d'acide. La réaction est rapide et totale. Recopier la formule de l'aspirine puis entourer et nommer les groupes caractéristiques.
La synthèse est réalisée en ajoutant quelques gouttes d'acide sulfurique au milieu réactionnel. Donner le nom d'une telle espèce. Quel est son rôle ? L'acide sulfurique joue le rôle de catalyseur : il accélère la réaction. Calculer les quantités de matière initiale des deux réactifs. n = m/M ; n( acide salicylique ) = 20/138 = 0,145 mol ~ 0,15 mol ; n( anhydride) = 30/102 = 0,294 mol ~0,29 mol.
Etablir le tableau d'avancement ; en déduire l'avancement maximal et la masse maximale mmax d'aspirine.
Si l'anhydride est en défaut : 0,294-xmax=0 soit xmax =0,294 mol On retient la plus petite valeur. A la fin de la synthèse on purifie l'aspirine et on obtient une masse d'aspirine mexp=19,6 g. Calculer le rendement de cette synthèse. nexp = 19,6 / 180 =0,109 mol rendement = nexp /xmax =0,109/0,145 = 33/36 = 0,752 (75 %).
|
|||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||