|
Influence du pH sur la stabilité du diiode en solution aqueuse concours Capes interne 2008 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
|
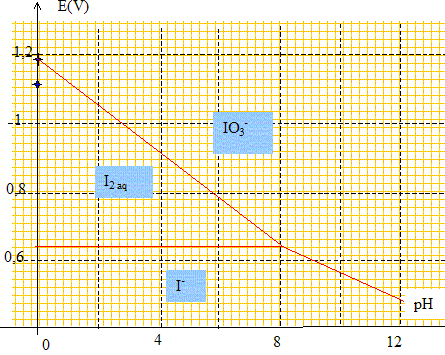
n.o(I) +3 n.o(O) = -1 avec n.o(O) - -2 d'où n.o(I) = +V. Soient les deux couples redox IO3- aq/I2aq et I2aq/I-aq. Ecrire les demi-équations électroniques pour ces deux couples. 2IO3- aq+ 12H+aq + 10e- = I2aq+ 6H2O. I2aq+2e- =2I-aq. Expliciter les potentiels d'électrode correspondants : E1 = E°(IO3- aq/I2aq ) + 0,06/10 log([IO3- ]2[H+]12/ [ I2]) E2 = E°( I2aq/I-aq ) + 0,03 log([ I2]/ [I-]2)
Le potentiel de Nernst dépend de la température. Justifier. Le potentiel de Nernst découle des potentiels chimiques : ces derniers dépendent de la température. On prendra les
concentrations des espèces
considérées égales à
0,100 mol/L sur cette frontière. E°(IO3-
aq/I2aq ) = 1,19 V ; E°(
I2aq/I-aq ) = 0,62
V. E1 = 1,19 - 6 10-3 +0,072 log [H+] ; E1 = 1,18 - 0,072 pH. à pH 0 : E1 = 1,18 V ; à pH=10 : E1 = 0,464 V ; E2 = 0,62 + 0,03 log([ 0,1]/ [0,1]2) = 0,62 +0,03 log 10 ; E2 =0,65 V. Tracer les diagrammes de prédominance des espèces relatives à ces couples et conclure quand à la stabilité du diiode à ces pH. IO3- aq+ 6H+aq + 6e- = I- aq+ 3H2O. E3 =E°(IO3- aq/ I- aq) + 0,01 log([IO3- ][H+]6/ [ I- ]) E3 =E°(IO3- aq/ I- aq) + 0,01 log ([IO3- ]/ [ I- ]) -0,06 pH
Que se passe t-il si on acidifie, sans variation de volume, la solution jusqu'à pH=0 ? Médiamutation : obtention d'un degré d'oxydation intermédiaire à partir de composés de degrés d'oxydation différents. 2IO3- aq+ 12H+aq + 10e- = I2aq+ 6H2O.(2) 10I-aq= 5I2aq+10e-. (3) (2) + (3) donne : IO3- + 5I- + 6 H+= 3I2 + 3H2O. (4) Calculer la constante d'équilibre correspondante. K = [I2]3 /([IO3-][I-]5[H+]6). E1 = E°(IO3- aq/I2aq ) + 0,06/10 log([IO3- ]2[H+]12/ [ I2]) E2 = E°( I2aq/I-aq ) + 0,03 log([ I2]/ [I-]2) A l'équilibre E1 =E2 : E°(IO3- aq/I2aq ) + 0,06/10 log([IO3- ]2[H+]12/ [ I2]) = E°( I2aq/I-aq ) + 0,03 log([ I2]/ [I-]2) E°(IO3- aq/I2aq ) - E°( I2aq/I-aq ) = 0,03 log([ I2]/ [I-]2) -0,006 log([IO3- ]2[H+]12/ [ I2]) E°(IO3- aq/I2aq ) - E°( I2aq/I-aq ) =0,006 log ([ I2]6/ ([IO3- ]2[H+]12[I-]10)) E°(IO3- aq/I2aq ) - E°( I2aq/I-aq ) =0,012 log K log K = (1,19-0,62) / 0,012 ; log K= 47,5 ; K = 3,2 1047. Valeur très grande, la réaction est quantitative. Quelle concentration maximale en diiode peut-on obtenir ? "n1 = 1,00 10-4 mole d'iodate de sodium (Na+ ; IO3-) et n2 = 2,00 10-2 mol d'iodure" L'ion iodate est en défaut ( réactif limitant) . D'après les nombres stoechiométriques de (4) : n(I2 )= 3 n(IO3-) = 3n1 = 3,00 10-4 mole de diiode dans V= 0,100 L [I2]max = 3,00 10-3 mol/L.
Quel doit être le pH de la solution pour obtenir 90% de cette concentration maximale en diiode ? [I2] =0,9 [I2]max = 2,70 10-3 mol/L soit xf = [I2] *V =2,70 10-4 mol
L'expression de K donne : [H+]6 = [I2]3/(K [IO3-][I-]5. [H+]6=( 2,70 10-3)3/[1047,5*10-4*0,19555]= 0,697 10-48. [H+] = 0,94 10-8 ; pH= 8,0.
|
|||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||
|
|