|
cinétique de dismutation de l'eau oxygénée : loi d'Arrhenius Concours Capes externe 2008 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La dismutation du peroxyde d'hydrogène peut être catalysée par les cations Fe3+. Fe3+/Fe2+. E° = 0,77 V Ecrire l'équation de la réaction de dismutation. H2O2 = H2O + O2. Proposer une explication au rôle des ions Fe3+. Le potentiel 0,77 V du couple Fe3+ / Fe2+ est compris entre le potentiel du couple O2/ H2O2 (0,69 V) et celui du couple H2O2 /H2O (1,77 V). L'ion Fe3+ peut donc catalyser la réaction de dismutation de l'eau oxygénée. La réaction de dismutation lente est remplacée par deux réactions rapides où intervient Fe3+. Expliquer pourquoi les ions fer (II) peuvent aussi servir de catalyseur pour cette réaction. En présence d'ion Fe3+, oxydant, l'eau oxygénée se comporte comme un réducteur. En présence d'ion Fe2+, réducteur, l'eau oxygénée se comporte comme un oxydant. La réaction étant supposée d'ordre 1, établir la loi donnant la concentration en eau oxygénée en fonction du temps. d[H2O2]
/
[H2O2]
= -kdt ; d ln
[H2O2]
= -kdt. Intégrer entre t=0 et t : ln
[H2O2]=
- kt + Cste. à t = 0, ln
[H2O2]0=Cste
d'où :
ln
([H2O2]0 /
[H2O2] =
kt.
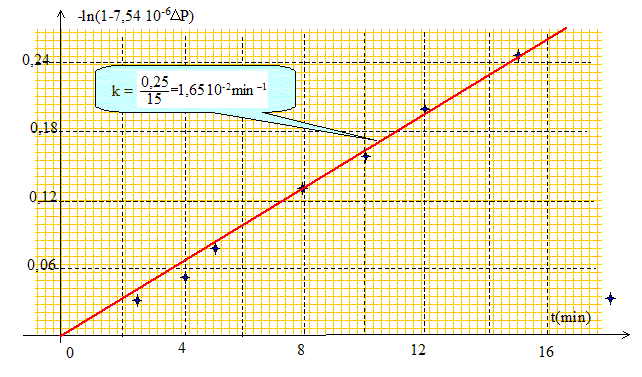
Vérifier que ces résultats sont bien compatibles avec une cinétique d'ordre 1.
La courbe est une droite :
l'hypothèse d'un ordre 1 est
vérifiée.
La même réaction a
été réalisée à trois
autres températures. On a obtenu les valeurs
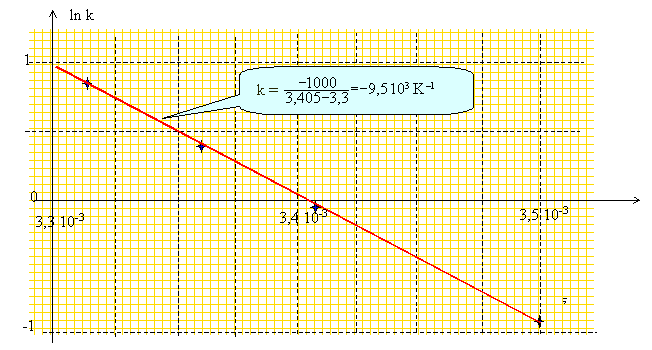
suivantes pour les constantes de vitesse : Quelle est la loi qui donne la variation de la constante de vitesse en fonction de la température ? loi d'Arrhenius. Quels sont ses critères d'utilisation ? Calculer l'énergie d'activation de cette réaction de décomposition de l'eau oxygénée. k = A exp (-EA/RT) ; ln k = ln A - EA/(RT) On trace : ln k = f (1/T)
Par suite -EA/R = -9,5 103 d'où EA = 8,32*9,5 103 = 79 kJ mol-1.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|