|
Complexation des ions chrome III par l'EDTA. BTS biotechnologie 2008. En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
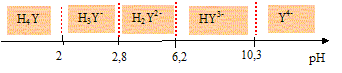
On se propose d'étudier la réaction de complexation des ions Cr3+ (aq) par l'E.D.T.A. en solution aqueuse maintenue à pH = 5,1. L'E.D.T.A. est un tétra-acide noté H4Y dont les pKa en solution aqueuse sont respectivement : H4Y / H3Y- pKa1 = 2,0 ; H3Y- /H2Y2- pKa2 = 2,7 ; H2Y2- / HY3- pKa3 = 6,2 ; HY3- / Y4- pKa4 = 10,3. Tracer le diagramme donnant sur une échelle de pH, les domaines respectifs des diverses espèces majoritaires.
Quelle est en conséquence l'espèce prédominante dans cette solution aqueuse sachant que son pH vaut 5,1 ? A pH =5,1, la forme H2Y2- est majoritaire. L'équation de la réaction de complexation à pH = 5,1 s'écrit sous la forme : Cr3+ + H2Y2- = CrY- + 2 H+. Le complexe CrY- formé est très stable. La transformation est lente et totale ; elle est d'ordre 1 par rapport aux ions Cr3+ et d'ordre 1 par rapport aux ions H2Y2- . La constante de vitesse est notée k. La solution contient initialement : - des ions H2Y2- de concentration molaire [H2Y2-]0 = 0,100 mol.L-1 et - des ions Cr3+ de concentration molaire [Cr3+]0 = 3,00 ×10-3 mol.L-1. On suit le déroulement de la réaction à température, volume et pH constants en mesurant la quantité de complexe formé et on obtient le tableau suivant
v =
k[Cr3+][H2Y2-].
Consigner dans un tableau les huit valeurs numériques de [Cr3+] pour chacune des dates t figurant dans le tableau ci-dessus. On suppose que la disparition des ions Cr3+ suit une loi de vitesse du premier ordre.
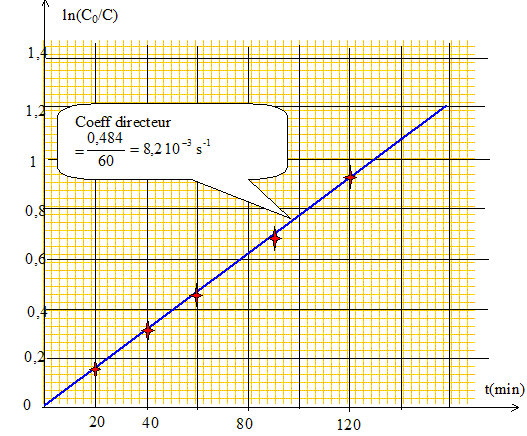
Donner sans démonstration la relation entre le temps t écoulé depuis le début de la réaction, la valeur correspondante [Cr3+] de la concentration des ions Cr3+ et la valeur initiale de la concentration en ions Cr3+, [Cr3+]0. ln([Cr3+]0 /[Cr3+]t ) = k' t. Montrer par une méthode graphique que la cinétique est d'ordre 1 par rapport aux ions Cr3+. On prendre obligatoirement pour échelle : 1 cm pour 10 minutes, 10 cm pour une unité logarithmique.
En déduire la valeur de la constante k'. Préciser son unité. k' =8,2 10-3 s-1. En déduire la valeur de la constante k. Préciser son unité. k' = k[H2Y2-]0 =0,1 k. k = 8,2 10-2 L mol-1 s-1.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|