|
Physico-chimie bac STL physique de laboratoire et procédés induxtriels 2008. Niveaux d'énerie : série de Balmer. |
||||||||||||||||||
|
||||||||||||||||||
|
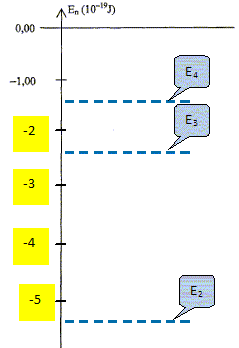
En= -13,6 / n2 avec n >=2. Où se trouve l'élément hydrogène dans la classification périodique de Mendeleïev ? L'élément hydrogène est le premier élément, situé en haut à gauche. En déduire le numéro atomique de l'élément hydrogène puis donner sa configuration électronique. Numéro atomique Z=1 ; configuration électronique 1s1. Calculer les niveaux d'énergie, en Joule, dans la série de Balmer pour n= 2, 3 et 4. 1 eV = 1,6 10-19 J. E3 = -13,6 / 32 = -1,51 eV
; -1,51 *1,6 10-19 = -2,42
10-19 J ~ -2,4
10-19 J. E4 = -13,6 / 42 = -0,85 eV
; -0,85 *1,6 10-19 = -1,36
10-19 J ~ -1,4
10-19 J.
L'énergie de l'atome diminue : une partie de l'énergie initiale de l'atome est cédée au milieu extérieur : on observe l'émission d'un photon. Calculer la longueur d'onde de la radiation émise lorsqu'un électron passe du niveau d'énergie E3 au niveau d'énergie E2. h = 6,62 10-34 Js ; c = 3 108 m/s E2-E3 = h c / l ; l = h c /(E2-E3 ) = 6,62 10-34 * 3 108/[(-2,42-(-5,44)) 10-19 ] = 6,57 10-7 m = 657 nm. Calculer la longueur d'onde de la radiation émise lorsqu'un électron passe du niveau d'énergie E4 au niveau d'énergie E2. E2-E4 = h c / l ; l = h c /(E2-E4 ) = 6,62 10-34 * 3 108/[(-1,36-(-5,44)) 10-19 ] = 4,87 10-7 m = 487 nm.
Compléter le tableau suivant et représenter ces transitions par des flèches.
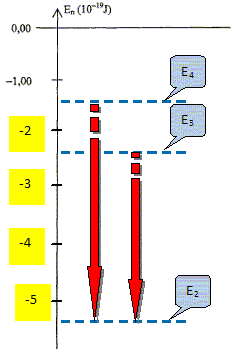
A quel domaine du spectre ( UV, visible, IR ) appartiennent les longueurs d'onde correspondant aux transitions E4-2 et E3-2 ? Justifier. Les longueurs d'onde sont comprises entre 400 nm et 800 nm : elles appartiennent au domaine visible.
|
||||||||||||||||||
|
|
||||||||||||||||||
|
|