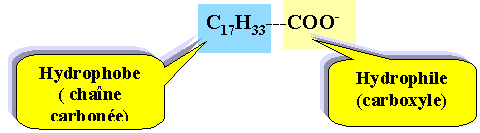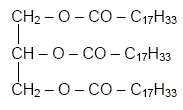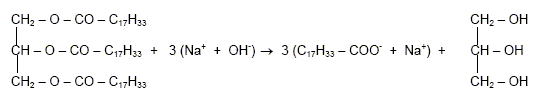|
eau oxygénée ; savon : propriétés, synthèse ; datation au carbone 14 bac SMS Antilles 2006. |
||||||||
|
||||||||
|
Données : On rappelle que dans les conditions normales de température et de pression, le volume molaire vaut Vm = 22,4 L.mol-1. Masses molaires M(H) = 1 g.mol-1 ; M(O) = 16 g.mol-1. Le titre T d’une eau oxygénée de concentration C en mole de peroxyde d’hydrogène par litre est le volume de dioxygène libéré par un litre de solution dans les conditions normales de température et de pression. Il s’exprime par la relation T =½CVm. L’eau oxygénée, antiseptique d’usage courant, est une solution aqueuse de peroxyde d’hydrogène qui se décompose très lentement à la température ordinaire. Un flacon est rempli à l’aide d’eau oxygénée fraîchement préparée de concentration molaire C = 0,89 mol.L-1. Les demi-équations électroniques intervenants dans cette décomposition sont : H2O2 + 2 H+ + 2 e- = 2 H2O (1) H2O2 = O2 +2 H+ + 2 e- A partir des deux demi-équations précédentes, écrire l’équation de la réaction de décomposition de l’eau oxygénée. puis après simplification :
2H2O2=
2 H2O +
O2.
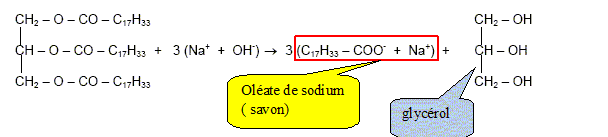
Savon. L’obtention d’un savon est un processus connu depuis l’Antiquité. Avec l’essor de la chimie au début du 19ème siècle, les procédés de fabrication se perfectionnent et les savons obtenus sont de meilleure qualité. Les matières premières sont immuables : un corps gras d’origine animale ou végétale et un alcali (solution fortement basique). Les savons actuels contiennent un grand nombre d’adjuvants ; agents surgraissants, colorants, parfums, etc. Le principal constituant d’un savon est un ion carboxylate qui donne au savon ses propriétés lavantes. On considère le plus courant des ions carboxylates : l’ion oléate qui a pour formule : CH3 – (CH2)7 – CH = CH – (CH2)7 – COO- L’action lavante d’un savon est due aux propriétés tensioactives de l’ion carboxylate. Recopier la formule de l’ion oléate et préciser les pôles hydrophile et hydrophobe. pôle hydrophile : – COO- pôle hydrophobe : CH3 – (CH2)7 – CH = CH – (CH2)7
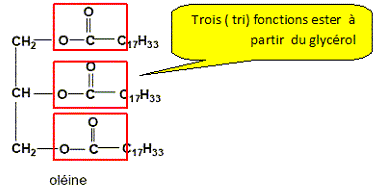
Pourquoi dit-on de l’acide oléique que c’est un acide gras est insaturé ? Les acides gras insaturés sont des acides carboxyliques contenant plus de 10 atomes de carbone et une ou plusieurs doubles liaisons carbone-carbone. Les acides gras sont des acides carboxyliques obtenus par hydrolyse de matières grasses appelées triglycérides. Qu’est-ce qu’un tryglycéride ? un triester du glycérol. L’oléine ou trioléate de glycéryle est, un triglycéride de formule :
Entourer les groupes fonctionnels caractéristiques "ester".
Comment se nomme cette réaction ? saponification. L’équation chimique correspondant à cette réaction s'écrit :
Nommer les produits obtenus et encadrer la formule chimique du savon.
Montrer que la quantité de matière d’oléine utilisée est nO = 0,283 mol. Masse molaire de l’oléine MOléine = 884 g.mol-1. n = m / M ; n =250/884 = 0,228 mol. Montrer que la quantité de matière de savon obtenu est : nS = 0,849 mol. Une mole d'oléine conduit à trois moles de savon. nS = 3 nO = 3*0,228 =0,849 mol. Calculer la masse ms de savon correspondant à cette quantité de matière. Masse molaire de l’oléate de sodium MSavon = 304 g/ mol. m = nS MS ; m = 0,849*304 = 258 g.
Datation par le carbone 14. En archéologie, on détermine l’âge de matériaux organiques à l’aide du carbone 14. Dans le cycle du carbone, l’élément est présent sous forme de deux isotopes, l’un stable le carbone 126C, (majoritaire), l’autre instable le carbone 14,146C (très minoritaire). Pourquoi le carbone 12 et le carbone 14 sont-ils appelés isotopes ? Ils possèdent tous deux le même nombre de protons ( 6) mais des nombres de neutrons différents : 126C : 12-6 = 6 neutrons ; 146C : 14-6 = 8 neutrons ; Le symbole d’un noyau se note AZX. Donner le nom des grandeurs représentées par les lettres Z et A, ainsi que leur signification. X : symbole de l'élément chimique ; Z : nombre de protons ; A : nombre de nucléons ( protons + neutrons) Donner la composition des noyaux des atomes de carbone suivants :126C ; 146C. 146C : 6 protons ; 14-6 = 8 neutrons. 126C : 6 protons ; 12-6 = 6 neutrons. La désintégration du noyau de carbone 14 conduit à l’émission d’un électron de symbole 0-1e et d’un noyau de symbole AZY. Après avoir précisé les lois de conservation utilisées, compléter l’équation de la réaction nucléaire correspondante. 146C --> AZY +0-1e. Conservation de la charge = 6 = Z-1 d'où Z=7. Conservation du nombre de nucléons : 14=A+0 d'où : 146C --> 147Y +0-1e. Les désintégrations radioactives peuvent être du type a, b + ou b -. Quelle est celle qui correspond à la désintégration du noyau de carbone 14 ? émission d'un électron donc type b -. Choisir parmi les noyaux ci-dessous celui qui correspond à Y. 115B ; 136C ; 147N ; 168O.
La période ou demi-vie du carbone 14 est T = 5570 ans. Donner la définition de la période T d'un radioélément. Durée au bout de laquelle l'activité initiale est divisée par 2 ; durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés. Le carbone 14 présent dans l'atmosphère est assimilé, comme le carbone 12, par les etres vivants. A leur mort, la quantité de carbone 14 contenue dans la substance organique diminue. On a retrouvé un morceau de bois lors de fouilles. A l'époque de son utilisation, il con qu'une masse m1 = 25 m g de carbone 14. Montrer qu’il s’est écoulé deux périodes entre les deux instants. Au bout d'une période la moitié du carbone 14 initial a disparu ; il en reste 50 mg . Au bout d'une nouvelle période, la moitié de ces 50 mg disparaît : il en reste 25 mg. Déterminer l’âge du morceau de bois. 2 périodes soit 2*5570 = 11 140 ans.
|
||||||||
|
|
||||||||
|
|