|
synthèse peptidique ; eau de Javel ; radioactivité : iode 131 bac SMS Réunion 2005. |
||||||||
|
||||||||
|
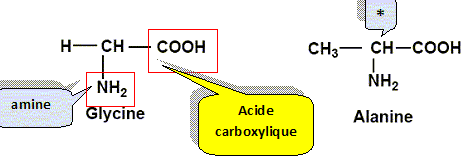
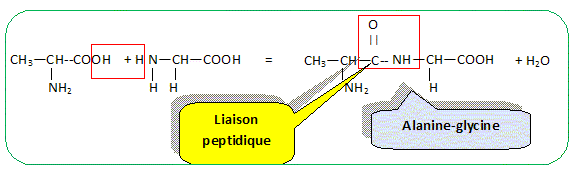
La glycine et l'alanine sont deux acides a-aminés dont les formules semi-développées planes sont les suivantes :
Recopier la formule de la glycine et entourer les groupes amine et acide carboxylique en les précisant clairement. Repérer, sur la formule recopiée de l’alanine, l’atome de carbone asymétrique à l’aide d’un astérisque.
L’eau de Javel, désinfectant d’usage courant, s’obtient par dismutation du dichlore en milieu basique. L’équation-bilan de cette réaction s’écrit à partir des 2 demi-équations électroniques suivantes : (1) Cl2 + 2e- = 2 Cl-. (2) Cl2 + 4 HO- = 2ClO- + 2 H2O + 2e-. Rappels : un oxydant est une espèce chimique capable de capter des électrons un réducteur est une espèce chimique capable de céder des électrons Dans l’écriture de la demi-équation (1) le dichlore est-il oxydant ou réducteur ? Écrire le couple redox concerné. Le dichlore gagne des électrons, c'est l'oxydant du couple Cl2 / Cl-. Dans l’écriture de la demi-équation (2), le couple redox concerné est ClO- / Cl2 : Donner le nom de l’ion de formule ClO-. hypochlorite. Préciser son rôle, « oxydant » ou « réducteur ». Le dichlore cède des électrons, c'est le réducteur ; ClO- est l'oxydant. A l’aide des demi-équations (1) et (2) précédentes, écrire l’équation-bilan de la réaction de dismutation du dichlore en milieu basique. ajouter (1) et (2) : Cl2 + 2e- + Cl2 + 4 HO- = 2ClO- + 2 H2O + 2e- + 2 Cl-. simplifier : 2Cl2 + 4 HO- = 2ClO- + 2 H2O + 2 Cl-. On appelle degré ou titre
chlorométrique d'une eau de Javel le volume
de dichlore, mesuré en litres dans les
conditions normales de température et de
pression, nécessaire à la fabrication
d'un litre de cette eau de Javel. Dans les conditions normales de température et de pression (C.N.T.P), le dichlore est-il un solide, un liquide ou un gaz ? gaz. Quel volume V1 de dichlore a été nécessaire pour la fabrication de 1 L de cette eau de Javel ? 48 ° chl donc V1 =48 L. En déduire le volume V2 de dichlore correspondant à la fabrication du contenu du berlingot. 250 mL = 0,25 L d'où V2 = 48*0,25 = 12 L. On verse le contenu du berlingot de 250 mL dans un flacon de capacité 1 L et on complète avec précaution à 1 L avec de l’eau. Comment appelle-t-on cette opération ? Dilution. Quel volume d’eau ajoute-t-on ? 1000-250 = 750 mL. Quel est alors le degré chlorométrique de l’eau de Javel diluée ainsi obtenue ? Le facteur de dilution vaut 1000/250 = 4 ( dilution au quart) La concentration du berlingot est donc divisée par 4 : 48/4 = 12°chl. L’eau de Javel ne doit jamais être mélangée à des détartrants contenant de l’acide chlorhydrique ; l’ensemble serait alors le siège de la réaction d’équation-bilan : ClO- + 2H+ + Cl- = Cl2 + H2O Préciser le nom et la formule du gaz toxique qui se dégagerait. dichlore Cl2. Le flacon préparé contient n = 0,54 mol d’ions hypochlorite. Quel volume maximal de gaz pourrait se dégager ? (donnée : volume molaire dans les C.N.T.P : Vm = 22,4 L.mol-1) D'après les nombres stoechiométriques, la quantité de matière de dichlore est égale à celle d'ion hypochlorite soit 0,54 mol. V = n.Vm = 0,54*22,4 =12 L.
Radioactivité : iode 131. L'iode existe sous plusieurs formes isotopiques comme 13153 I , nucléide radioactif utilisé en médecine comme traceur et 12753 I, non radioactif. Donner la composition des noyaux 13153 I et 12753 I. 13153 I : 53 protons et 131-53 = 78 neutrons. 12753 I : 53 protons et 127-53 = 74 neutrons. Définir des isotopes. Des isotopes ont le même nombre de protons et des nombres de neutrons différents. Rappeler les lois de conservation appliquées pour écrire une équation de désintégration radioactive. Conservation de la charge et conservation du nombre de nucléons. Ecrire l'équation de désintégration nucléaire de type b- du nucleide 13153 I (émission d'un électron) en vous aidant des données suivantes : 52Te ; 53 I ; 54Xe ; 55Cs. 13153 I --> AZ X + 0-1 e conservation de la charge : 53 = Z-1 d'où Z = 54, on identifie le xénon Xe. conservation du nombre de nucléons : A = 131. 13153 I --> 13154 Xe + 0-1 e. La période ou demi-vie de l'iode 131 est T = 8 jours. Définir la période radioactive. Durée au bout de laquelle l'activité initiale est divisée par 2 ; durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés. L'échantillon d'iode étudie a une masse m0 = 8.10-3 g à l'instant t = 0. Calculer la masse m d'iode 131 qui restera à la date t = 16 jours correspondant à 2 périodes. Au bout de huit jours la moitié de l'iode se désintègre : il reste ½m0 = 4 10-3 g. Au bout d'une nouvelle période la moitié de ces 4 10-3 g a disparu : il restera : 2 10-3 g. Au bout de combien de temps peut-on considérer le radioélément comme inactif ? Environ 8 périodes soit 8*8 = 64 jours.
|
||||||||
|
|
||||||||
|
|