|
Pile et charge d'un condensateur bac S Reunion 2008. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||
|
|||||||||||||
|
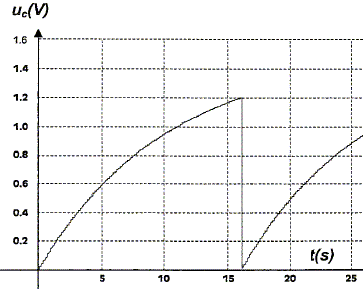
- Tant que la tension uC aux bornes du condensateur est inférieure à 1,2 V, le système S est équivalent à un interrupteur ouvert ( de résistance infinie). - Lorsque uC atteint la valeur uf=1,2 V, le système S est équivalent à un interrupteur fermé ( de résistance nulle) provoquant la décharge instantanée du condensateur. Et le cycle recommence...
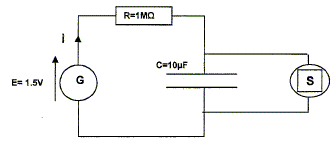
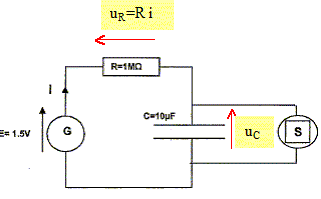
Etude électrique. La pile est considérée comme un générateur idéal de tension E=1,5 V ; R = 1 MW ; C= 10 mF. La durée de la décharge est négligeable devant celle de la charge. La valeur de la tension de basculement charge / décharge est 1,2 V. Les tensions aux bornes de la résistance et du condensateur, notées respectivement uC et uR, respectent la convention récepteur. Tracer sur la figure les flèches correspondant à uR et à uC.
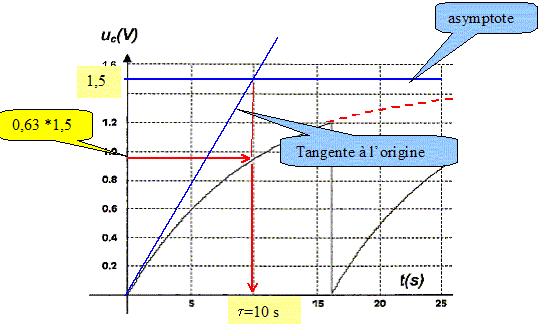
uC/ E=1-exp(-t/t) ; 1-uC/ E = exp(-t/t) ; ln [1-uC/ E] = -t/t. t = -t ln [1-uC/ E]. Calculer la valeur de tf et vérifier l'accord avec la figure. En déduire la fréquence du phénomène périodique. tf = -10 ln[1-1,2/1,5] =16,1 s ~16 s. ( sur la figure on lit tf=16 s) fréquence f = 1/tf =1/16,1 =6,2 10-2 Hz.
Intensité dans le circuit de charge : Etablir l'expression de i à partir de uC. i=dq/dt et q= CuC = CE (1-exp(-t/t)) avec t= RC. Dériver la charge par rapport au temps : i = dq/dt = CE/t exp(-t/t) ; i = E/R exp(-t/t). Calculer les valeurs de i aux dates t=0 et tf. i(0) = E/R = 1,5 10-6 A = 1,5 mA. i(16) = 1,5 10-6 exp(-16,1/10) =3,0 10-7 A = 0,30 mA. Aspects énergétiques. On désigne par Eélec l'énergie stockée dans le condensateur à une date t quelconque. Rappeler l'expression de Eélec en fonction de C et uC. Préciser les unités des grandeurs utilisées.
Eélec = 0,5 *10-5*1,22 =7,2 10-6 J = 7,2 mJ. Sur la durée d'un cycle, l'énergie totale délivrée par la pile est EG= 18 mJ. Comment expliquer la différence entre les valeurs EG et Eélec ? L'énergie électrique fournie par la pile est d'une part stockée en partie dans le condensateur et d'autre part dissipée par effet joule ( chaleur) dans le résistor R.
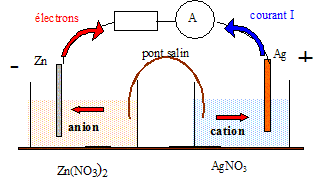
Etude chimique de la pile. La pile zinc argent est constituée de deux demi-piles reliées par un pont salin et mettant en jeu les couples oxydant / réducteur Zn2+aq / Zn (s) et Ag+aq / Ag (s). Chaque demi-pile contient 100 mL de solution, l'une de nitrate de zinc ( Zn2+aq +2NO3-aq), l'autre de nitrate d'argent (Ag+aq +NO3-aq). Les concentrations apportées de chacun des électrolytes sont identiques et valent c0=0,100 mol/L. Chacune des deux électrodes a une masse de 1,0 g. Equations de dissolution, concentrations initiales : Ecrire les équations de dissolution dans l'eau des deux solides ioniques ayant permis de réaliser les solutions électrolytiques. AgNO3(s) = Ag+aq +NO3-aq. Zn(NO3)2 (s) = Zn2+aq +2NO3-aq. En déduire les concentrations de tous les ions présents dans chacune de ces solutions aqueuses. La solution de nitrate d'argent est électriquement neutre : [ Ag+aq]=[NO3-aq]=c0. La solution de nitrate de zinc est électriquement neutre : 2 [ Zn2+aq] = [NO3-aq] [ Zn2+aq] = c0 ; [NO3-aq] = 2c0. Demi-équations; équation chimique : Ecrire la demi-équation associée à chaque couple oxydant /réducteur. Zn2+aq + 2e- =Zn (s) et Ag+aq+e- = Ag (s). Parmi les deux réactions pouvant se produire à priori lors du fonctionnement de la pile, écrire celle pour laquelle le métal argent intervient en tant que réactif. 2 Ag (s) = 2Ag+aq+2e-. Zn2+aq + 2e- =Zn (s) puis additionner : 2 Ag (s) + Zn2+aq = 2Ag+aq+Zn (s). La constante d'équilibre de cette réaction vaut K=10-52. Sens d'évolution, polarités : Calculer le quotient initial Qr i de la réaction précédente et prévoir le sens d'évolution spontané du système chimique constituant la pile. Qr i = [Ag+aq] i2/ [Zn2+aq] i = c02/c0 = c0 = 0,10. Qr i > K: le critère d'évolution spontané indique une évolution dans le sens indirect.
Ecrire l'équation de la réaction dans le sens où elle évolue spontanément. 2Ag+aq+2e-= 2 Ag (s) Zn (s)= Zn2+aq + 2e- puis additionner : 2Ag+aq+Zn (s) =2 Ag (s) + Zn2+aq. Rappeler les définitions d'un oxydant et d'un réducteur, et les identifier dans la transformation spontanée observée. Un oxydant est une espèce susceptible de gagner des électrons ( ici l'ion Ag+aq ) Un réducteur est une espèce susceptible de donner des électrons ( ici le métal Zn(s)) En déduire en le justifiant les polarités des électrodes. Zn (s)= Zn2+aq + 2e- : le métal zinc libère des électrons : c'est l'anode négative de la pile. 2Ag+aq+2e-= 2 Ag (s) : les électrons gagnent le métal argent par le circuit extérieur : l'argent constitue le pole positif de la pile. Comment est assurée l'électroneutralité des solutions lors du fonctionnement de la pile ? Le compartiment contenant l'électrode de zinc s'enrichi en cations : des anions négatifs migrent vers ce compartiment à partir du pont salin. Le compartiment contenant l'électrode d'argent s'appauvri en cation argent : des cations positifs migrent vers ce compartiment à partir du pont salin. Faire le schéma de la pile en fonctionnement. Indiquer les espèces chimiques, les polarités, le sens du courant, le sens de déplacement des porteurs de charge ( hors pont salin).
|
|||||||||||||
|
|
|||||||||||||
|
|