|
utiliser le beurre pour dissoudre une tache de graisse d'après bac Afrique 2005 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||
|
|||||
|
A travers les quatre parties abordées, nous allon essayer de comprendre les étapes de fabrication d'un savon à partir d'un morceau de beurre, dans le but de dissoudre une tache de graisse à la surface d'un tissu. I. Fabrication d'un ester à partir d'un acide carboxylique. L'acide butyrique, composé A, est un acide carboxylique de formule semi-développée CH3-CH2-CH2-COOH. Dans la nomenclature officielle, le nom de l'acide butyrique est acide butanoïque.
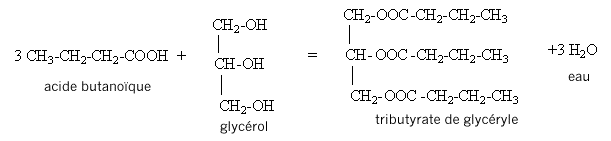
- Quelle est la nature du produit D ? CH3-CH2-CH2-COOH. L'action de l'acide butanoïque sur un alcool, le propan-1-ol CH3-CH2-CH2-OH conduit à la formation d'un ester ( noté C) , le butanoate de propyle et à de l'eau ( notée D). II. Synthèse d'un corps gras : la butyrine. La butyrine, appelée aussi tributyrate de glycéryle, est un corps gras ( ou triester) présent dans le beurre. Cette molécule résulte de l'action de l'acide butyrique sur le glycérol de formule semi-développée : 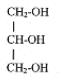
Qté de matière d'acide butyrique : n1 (mol = masse (g) / masse molaire (g/mol) = 39,6 / 88,0 = 0,450 mol. D'après les coefficients de l'équations bilan, 0,450 mol d'acide butyrique peut réagir avec 0,150 mol de glycérol : donc les réactifs sont en proportions stoechiométriques.
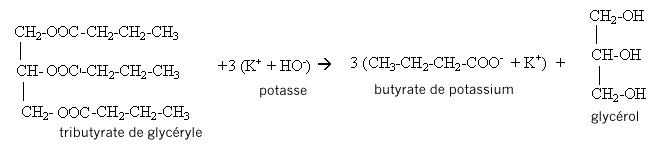
D'après les coefficients de l'équation, la quantité de matière (mol) de triester est égale à la quantité de matière (mol) de glycérol : on peut donc espérer obtenir au plus 0,150 mol de triester. soit une masse (g) = masse molaire (g/mol) * Qté de matière (mol) = 302*0,150 = 45,3 g. rendement = masse réelle obtenue(g) / masse théorique (g) prévue = 29/45,3 = 0,640 (64,0%). III. Fabrication d'un savon mou à partir du beurre : Le beurre contient plusieurs corps gras, l'oléine, la palmitine et la butyrine. La butyrine représente 35 % en masse du beurre. Nous n'étudierons que la fabrication du savon à partir de la butyrine. Pour cela nous allons faire réagir 20 g de beurre avec un excès de potasse ( K+ + HO-) concentrée. Après 30 min de chauffage, on observe après relargage, la formation d'un précipité jaune.
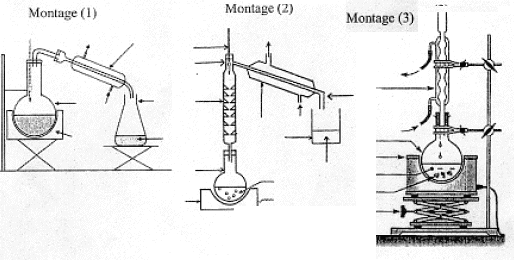
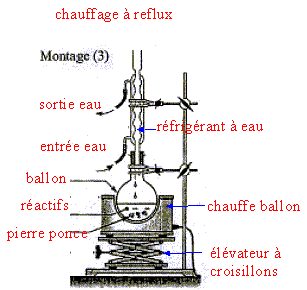
réaction de saponification du triester, lente à température ambiante, rapide à chaud mais totale
Dans 20 g de beurre il n'y a que 20*0,35 = 7 g de butyrine soit masse (g) / masse molaire (g/mol) = 7/302=2,317 10-2 mol D'après l'équation de la saponification on peut espérer obtenir au plus 3*2,317 10-2 = 6,95 10-2 mol de savon en tenant compte du rendement de la saponification : 6,95 10-2*0,85 = 5,91 10-2 mol de savon masse de savon (g) = Qté de matière (mol) * masse molaire (g/mol)=126*5,91 10-2 = 7,4 g.
IV. Utilisation du savon fabriqué pour dissoudre une tache de graisse : Après élimination de l'excès de potasse, on souhaite étudier les qualités détergentes du savon sur une tache de graisse. Le savon est composé d'ion carboxylates qui peuvent être modélisés des deux façons suivantes :  Le schéma ci-dessous représente une tache de graisse à la surface d'un tissu plongé dans l'eau savonneuse ( étape n°1) et sa dislocation par action du savon synthétisé précédemment (étape n°2) 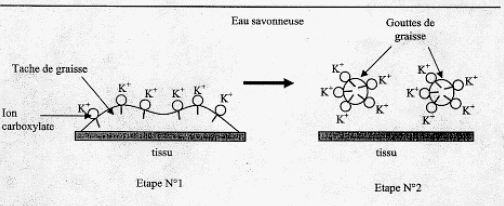 En vous aidant du shéma précédent, identifier la composition et la propriété de chacune des deux parties de l'ion carboxylate modélisé. partie 2 : groupe (- COO-)est lipophobe et hydrophyle. La partie lipophile du savon se fixe sur la goutte de graisse ( ou de corps gras) ; par son extrémité hydrophile, le savon entraîne la goutte de graisse ( ou du corps gras) dans l'eau.
|
|||||
|
|
|||||
|
|