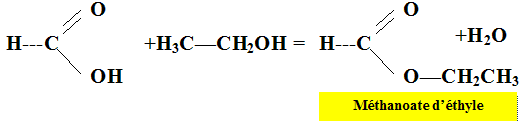|
Synthèse d'un ester à odeur de rhum bac S Antilles 09/08. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||
|
||||||||||||||||||
|
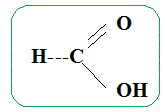
On chauffe à reflux pendant une vingtaine de minutes, puis on verse le contenu du ballon dans un grand becher contenant de l'eau glacée. Etude de la réaction. Ecrire la formule semi-développée de l'éthanol. CH3-CH2OH. Ecrire la formule semi-développée de l'acide méthanoïque.
Quel est le nom de
l'ester ? (
nomenclature officielle) Quel est l'intérêt
du chauffage à reflux ? En travaillant à température modérée
on accélère la réaction : la température
est un facteur cinétique. On évite les pertes de matière : les vapeurs
se condensent dans le réfrigérant à eau
et retombent dans le milieu réactionnel. A la place de l'acide paratoluène
sulfonique on aurait pu utiliser de l'acide sulfurique. Quel est le rôle de ces deux
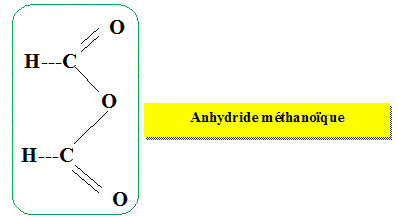
acides ? Catalyseur. Pour augmenter le rendement de
cette synthèse, on aurait pu utiliser, à la
place de l'acide méthanoïque, un autre réactif. Donner sa formule semi-développée
et son nom.
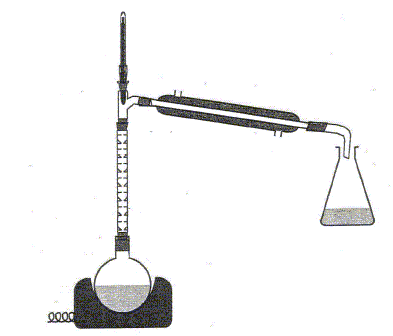
Pour améliorer le rendement sans changer la nature des réactifs, on aurait pu utiliser le dispositif ci-dessous :
Distillation
fractionnée. Après avoir identifier, à l'aide du tableau de données ci-après, la première espèce chimique récupérée dans l'erlenmeyer, expliquer pourquoi ce dispositif permet d'améliorer le rendement.
acide méthanoïque + éthanol = ester + eau. La constante d'équilibre de cette réaction s'écrit :
Le quotient de réaction Qr est constamment nul, si on retire par distillation l'ester au fur et à mesure qu'il se forme. Qr <K : d'après le principe d'évolution spontané, la réaction directe, formation de l'ester, est favorisée. En éliminant un produit au fur et à mesure qu'il se forme, on déplace l'équilibre dans le sens direct : le rendement est donc amélioré.
|
||||||||||||||||||
|
|
||||||||||||||||||
|
|