|
L'eau de Javel
: suivi
cinétique
bac S Antilles
2008. |
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
volume Vb=250 mL ; solution d'hypochlorite de sodium (Na+ aq + ClO-aq) dilution : introduire un berlingot dans un flacon de 1 L et compléter avec de l'eau A utiliser dans les trois mois suivant l'achat. Préparation du dichlore : L'eau de Javel est préparée industriellement par réaction entre le dichlore Cl2 et la soude (Na+ aq + HO-aq ). Le dichlore est obtenu par une électrolyse d'une solution aqueuse de chlorure de sodium (Na+ aq + Cl-aq ) Quelle transformation subissent les ions chlorure lors de l'électrolyse ? Ecrire la demi équation associée. Quel est le nom de l'électrode où a lieu cette transformation ? Oxydation à l'anode des ions chlorures : 2Cl-aq = Cl2 + 2e-. Afin de préparer en 90 min la solution commerciale dont l'étiquette est donnée ci-dessus, il faut obtenir 0,525 mol de dichlore à partir de la solution électrolysée. La transformation est considérée
comme totale ; 1 F = 9,65 104 C
mol-1. D'après les nombres
stoechiomètriques de la demi-équation
ci-dessus : ne = 2 nCl2 = 2*0,525
=1,05
mol. Quantité d'électricité
correspondante :
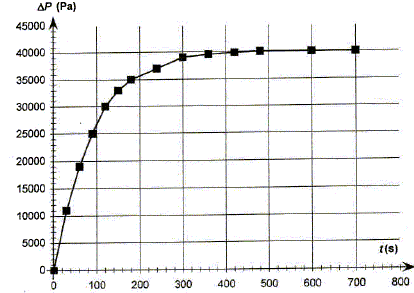
La réaction s'effectue dans un ballon de volume VB=1,2 L hermétiquement fermé. On mesure à température constante, la variation de pression DP due au dioxygène gazeux produit. Dans ce ballon on introduit V1 = 100 mL de la solution S1 puis on déclenche le chronomètre au moment où l'on met le catalyseur dans la solution. On montre que la pression mesurée Pmes dans le ballon à une date t a pour expression : Pmes =P0 +n(O2) RT/VB. T= 290 K ; pression initiale dans le ballon P0 =1,00 105 Pa ; n(O2) quantité de matière dioxygène R = 8,31 SI ; on néglige le volume de la solution devant le volume gazeux. Montrer que l'avancement x de la réaction a pour expression x= 5,0 10-7 DP.
RT/VB = 8,31*290/1,2 10-3 =2,00 106. DP = 2,00 106 x ; x= 5,0 10-7 DP. On relève la pression à différentes dates et on trace la courbe DP=f(t).
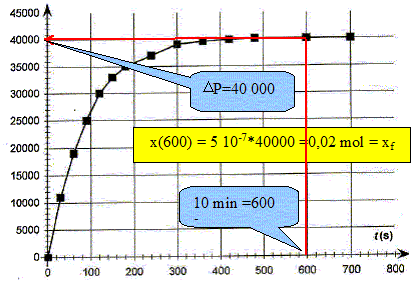
Déterminer la valeur de l'avancement final xf. DP final = 40 000 Pa ; xf = 5,0 10-7 DPfinal = 5,0 10-7 *40 000 =2,0 10-2 mol.
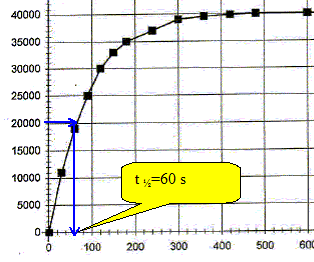
Donner la définition du temps de demi-réaction t½ et le déterminer graphiquement. Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final. xt½ = 0,5 xf = 0,01 mol ; DPt½ =xt½ / 5 10-7 = 0,01 / 5 10-7 = 20 000 Pa.
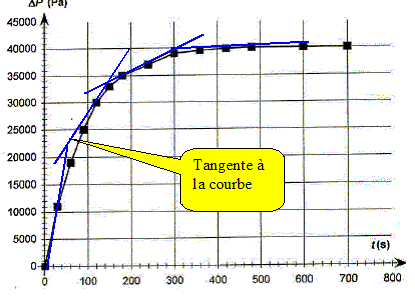
La vitesse volumique de la réaction étudiée est donnée par : v = 1/V1 dx/dt Préciser l'unité de la vitesse de réaction. mol L-1 s-1. En déduire que v = 5,0 10-6 d(DP)/dt. x= 5,0 10-7 DP ; dx/dt = 5,0 10-7 d DP /dt ; V1 = 0,1 L par suite : v = 5,0 10-6 d(DP)/dt. Comment évolue qualitativement la vitesse volumique de la réaction au cours du temps. Justifier à partir de le courbe. [d DP /dt ]t représente le coefficient directeur de la tangente à la courbe DP=f(t) à la date t. Les tangentes sont de moins en moins inclinées par rapport à l'horizontale au cours du temps : [d DP /dt ]t diminue donc et en conséquence la vitesse décroît au cours du temps . Conservation de l'eau de Javel. Le degré chlorométrique français de l'eau de Javel correspond au volume de dichlore gazeux, exprimé en litre, ( à une température de 273 K et sous une pression de 1 bar) nécessaire à la préparation d'un litre d'eau de Javel suivant une transformation totale modélisée par l'équation : Cl2(g) + 2HO-aq = ClO-aq + Cl-aq + H2O(l). Dans les conditions de l'expérience, la quantité de matière de dichlore nécessaire à la fabrication d'un litre d'eau de Javel à 48 ° est donc n(Cl2)= 2,10 mol. Déterminer la concentration molaire c0 en ion hypochlorite de l'eau de Javel contenue dans un berlingot. D'après les nombres stoechiométriques de l'équation ci-dessus : n(Cl2)=n(ClO-aq ) = 2,10 mol dans 1 L Or le volume d'un berlingot est Vb = 0,25 L : la quantité de matière d'ion hypochlorite dans un berlingot est donc : 2,10*0,25 = 0,525 mol. [ClO-aq ] = n(ClO-aq ) / Vb = 0,525 / 0,25 =2,10 mol/L. En déduire la concentration c1 de la solution S1. La solution mère S0 a été dilué 4 fois : c1 = c0/4 = 0,525 mol/L. Déterminer la quantité d'ion hypochlorite restant dans la solution après 10 minutes de décomposition. Conclure.
En présence de catalyseur, en 10 minutes les ions hypochlorite ont complétement disparu. En absence de catalyseur, la réaction est plus lente : néanmoins au bout de 2 à 3 mois, les ions hypochlorite auront pratiquement tous disparu. Il faut donc utiliser assez rapidement l'eau de Javel après son achat.
|
|||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||
|
|