|
enseignement, concours CAPLP externe 2006 : propriétés acido-basiques de quelques ions contenant l’élément chlore ; dosage de l'eau de javel En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts.
|
|||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
Cl2 + 2 Na+aq + 2 HO-aq= 2 Na+aq + Cl-aq+ ClO-aq Données : Masses molaires (g.mol-1) : C : 12,0 ; H : 1,0 ; O : 16,0 ; acide hypochloreux : acide faible de pKa (HClO / ClO-) = 7,5 Numéros atomiques : oxygène : Z = 8 ; Chlore : Z = 17 E° (ClO- / Cl-) = 1,72 V ; E° (I2 /I-) = 0,62 V ; E° (SO42- / HSO3-) = 0,08 V ; E° (S4O62- / S2O32-) = 0,09 V ; R = 8,32 J mol-1 K-1. Configuration électronique à l’état fondamental de l'atome de chlore : 1s2 2s2 2p6 3s2 3p5. Famille chimique de l’élément chlore : halogènes ( le fluor, le brome, l'iode ) Formule de Lewis de
l’acide hypochloreux : Géométrie de l’acide hypochloreux en utilisant la méthode VSEPR : L'atome d'oxygène, atome central, met en jeu deux liaisons de covalence et possède deux doublets non liants type AX2E2,
la molécule a la forme d'un V avec un angle proche de
109°.
couple acide base : HClO /
ClO- : pKa = 7,5 ( Ka = 3,16
10-8)
Dosage de l’eau de Javel : L’hypochlorite de sodium (Na+ + ClO-) réagit avec une solution d’iodure de potassium mis en excès. L’ion iodure, en milieu acide et en présence d’ions hypochlorite, donne du diiode : couples redox : ClO-/Cl- : réduction de l'oxydant ClO-. ClO- +2H++2e-= Cl- +H2O I2/I- : oxydation du réducteur I- : 2I- = I2 + 2e-. Equation de la réaction :
ClO- +2H++2I- =
I2 + Cl- +H2O
(1)
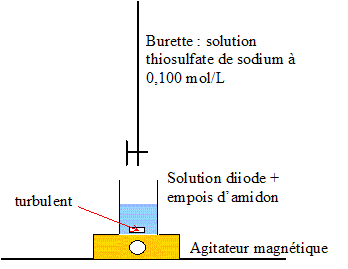
Le diiode issu de la réaction précédente est dosé par une solution de thiosulfate de sodium.
Définition de l’équivalence : A l'équivalence les quantité de matière des réactifs mis en présence sont en proportions stoechiométriques. L’équivalence est repérée par le changement de couleur de l'indicateur coloré. ( teinte violette à l'incolore) Equation de la réaction de dosage : I2/I- : I2 + 2e- = 2I- ; S4O62- / S2O32- : 2S2O32- = S4O62- + 2e- Bilan : 2S2O32- + I2= 2I- + S4O62-(2) à l'équivalence n(I2) = ½ n(S2O32- ) Sachant qu’à l’équivalence on a versé un volume V1 = 21,1 mL de thiosulfate de sodium de concentration C1 = 0,100 mol L-1, n(I2) = 0,5*C1V1 =0,5*0,100*21,1 10-3 = 1,055 10-3 mol Sachant que le volume d’eau de Javel introduit initialement est V2 = 2,00 mL, calcul de la concentration en ClO- de cette solution commerciale. d'après (1) n(ClO-)= n(I2) = 1,055 10-3 mol dans 2 10-3 L [ClO-]=1,055 10-3 /2 10-3 =5,27 10-1 mol/L. |
|||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||
|
|