|
enseignement, concours caplp externe 2005 : solution de chlorure d'hydrogène En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
Composition du noyau : 17 protons et A-Z=35-17 = 18 neutrons. Cortège électronique de l’atome : 1s2 2s2 2p6 3s2 3p5. Cet atome à tendance à compléter sa couche électronique externe à 8 électrons et donne facilement l'ion chlorure Cl-. La molécule de chlorure d’hydrogène : La représentation de Lewis : HCl est une molécule polaire : l'atome de chlore est beaucoup plus électronégatif que l'atome d'hydrogène et attire à lui le doublet de liaison. Volume occupé par 7,3 g de ce gaz si la température est de 20°C et la pression de 900 hPa, en assimilant ce gaz à un gaz parfait : PV= nRT soit V= nRT/P avec n = m/M = 7,3 / 36,5 = 0,20 mol ; T= 273+20 = 293 K ; P = 9 105Pa et R = 8,32 S.I V= 0,2*8,32*293 / 9 105 =5,4 10-4 m3 = 0,54 L. La solution aqueuse de chlorure d’hydrogène (acide chlorhydrique) : L'expérience du jet d'eau illustrela solubilité du chlorure d’hydrogène dans l’eau et le caractère acide de la solution obtenue : retourner un ballon contenant du chlorure d'hydrogène sur un cristallisoir contenant de l'eau et un indicateur coloré acido-basique ( hélianthine). Le chlorure d'hydrogène se dissout dans l'eau : il en résulte une dépression dans le ballon et une aspiration du liquide.
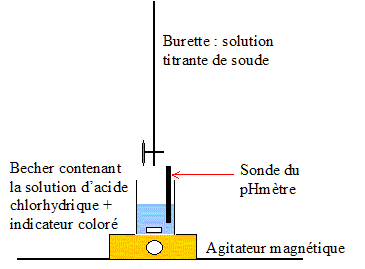
Equation de la réaction qui se produit lors de la dissolution du chlorure d’hydrogène dans l’eau : HCl+ H2O = H3O++Cl-. Quantité de matière en chlorure d’hydrogène dissoute dansV= 400 mL= 0,4 L de solution de pH = 2,5 : [H3O+]= 10-pH=10-2,5 =3,16 10-3 mol/L n= [H3O+]V = 3,16 10-3 *0,40 =1,3 10-3 mol. Dosage pHmétrique d’une solution d’acide chlorhydrique par une solution de soude : Le dispositif expérimental permettant un tel dosage :
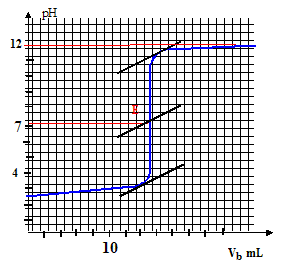
Choix de l’indicateur coloré le mieux adapté pour visualiser, lors du dosage rapide préliminaire, le passage par l’équivalence : le pH au point équivalent vaut 7 ( milieu neutre : solution de chlorure de sodium ) ; la zone de virage de l'indicateur coloré doit contenir la valeur pH au point équivalent : d'où le choix du BBT. La solution titrante de soude a une concentration Cb= 1,00.10-2 mol.L-1. La prise d’essai est deVa = 20,0 mL. L’équivalence est obtenue pour un volume de solution de soude versé Vb= 15,3 mL. Concentration molaire et la concentration massique de la solution titrée. : C= CbVb/Va =0,01*15,3/20 = 7,65 10-3 mol/L. Allure de la courbe pH = f (vb), vb étant le volume de solution basique versé :
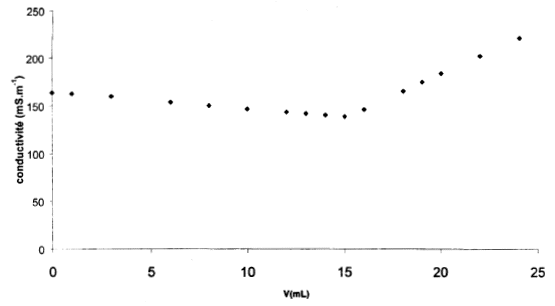
Ce dosage peut être aussi réalisé par conductimétrie.On suit l’évolution de la conductance G ( siemens) de la solution. Le «capteur» placé dans la solution est la sonde du conductimètre. L’allure de la courbe btenue est :
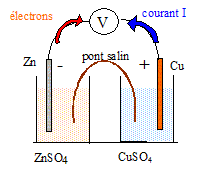
La solution d’acide chlorhydrique et l’oxydoréduction : Une réaction chimique se produit quand on plonge une lame de zinc dans une solution d’acide chlorhydrique mais aucune réaction ne se produit quand on y plonge une lame de cuivre. Equation de la réaction entre le zinc et la solution d’acide chlorhydrique : Le zinc s'oxyde suivant Zn = Zn2+ + 2e- l'ion oxonium H3O+ se réduit : 2H3O++ 2e- =H2 + 2H2O Bilan : Zn + 2H3O+ = Zn2+ + H2 + 2H2O Le couple redox de référence dont le potentiel est nul est le couple H3O+/ H2 Le potentiel du couple redox Zn2+/Zn est négatif : Zn est plus réducteur que H2 ; le zinc est attaqué par l'acide chlorhydrique. Le potentiel du couple redox Cu2+/Cu est positif : Cu est moins réducteur que H2 ; le cuivre n'est attaqué par l'acide chlorhydrique. On souhaite réaliser une pile mettant en jeu les couples Cu2+/Cu et Zn2+/Zn. Schéma de cette pile :
|
|
|
|
|
|
|