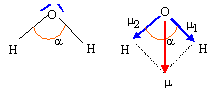|
enseignement, chimie, agrégation interne 2006 : l'eau est un solvant polaire, protique, dissociant En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||
| .
. |
|||
|
|||
|
nombre de protons dans le noyau d'un atome ou d'un ion d'un élément chimique. Configurations électroniques des atomes d'hydrogène et d'oxygène dans leur état fondamental : O : 1s2 2s2 2p4 ; H : 1s1. Règle de Klechkowski : Les orbitales atomiques sont classées d'après leur énergie : celle-ci croît avec les valeurs croissantes des nombres quantiques n+l ; à égalité de valeur, l'énergie augmente avec n. Electrons de valence : Ce sont les électrons externes pour lesquels le nombre quantique principal n est le plus élevé ; il faut aussi prendre en compte les électrons d'une sous couche incomplète. Schéma de Lewis d'un atome : Dans ce type de schéma, seuls les électrons
de valence sont représentés ; un tiret
correspond à un doublet ( deux électrons,
orbitale occupée) ; un point correspond à un
électron célibataire. Ces deux atomes possèdent des électrons célibataires dans leur état fondamental : ce sont donc des radicaux. Isotopes de l'élément hydrogène : hydrogène 11H ; deutérium 21H ; tritium 31 H. Schéma de Lewis de la molécule d'eau
: géométrie de la molécule d'eau : modèle VSEPR type AX2E2 : 2 paires liantes et deux doublets non liants autour de l'oxygène, atome central. Ces 4 paires se disposent autour de l'atome central, de telle manière que les répulsions soient minimales. La molécule d'eau à la forme d'un V : l'angle est inférieur à 109 ° 28 , la répulsion entre les doublets non liants étant plus importante que la répulsion entre les doublets liants.
L'eau est un solvant polaire : Le moment dipolaire de cette molécule, noté PH2O vaut 1,85 D. L'expérience suivante met en évidence ce moment dipolaire : Une règle en plexiglas est électrisée par frottements ; on l'approche d'un mince filet d'eau coulant du robinet : le filet d'eau est dévié. Pourcentage du caractère ionique de la liaison OH : dO-H = 96 pm
m1 = m2 ; m = 2 m1 cos (½a) ; m1 =m / ( 2cos (½a)) = 1,85 / (2*cos (104,5 / 2 )) = 1,52 D. or 1 Debye = 1D = 3,33 10-30 C m d'où m1 =1,52* 3,33 10-30 = 5,06 10-30 C m Pourcentage de caractère ionique : m1
/( e dOH) = 5,06 10-30 / (1,6
10-19 * 96 10-12) = 0,329 (
33
%).
L'énergie associée à ces forces est de 10 à 100 fois plus faible que l'énergie associée à une liaison covalente : c'est à dire de l'ordre de 0,1 à 10 kJ/mol. On distingue sous cette appellation trois type d'interactions : dipôle permanent- dipôle permanent ( Keesom) ; dipôle permanent - dipôle induit ( Debye) ; dipôle induit - dipôle induit ( London ) Cette dernière est toujours présente,
étant liée à la polarisabilité
des molécules.
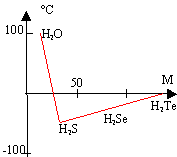
Cette liaison est plus intense que l'interaction de van der Walls : son énergie est de l'ordre de 30 kJ/mol. C'est une liaison entre un atome d'hydrogène et un atome électronégatif ( O, N, F) Conséquences : Température
d'ébullition normale en fonction de la masse molaire
des hydrures. Les
températures d'ébullition augmentent
avec la masse molaire sauf pour l'eau où la
valeur est anormalement élevée.
Explication : présence de liaisons
hydrogènes intermoléculaires formant
des associations moléculaires. D'autre
part H2Te est plus polarisable que
H2Se ; les interactions de London seront
plus grandes dans H2Te que dans
H2Se : la température
d'ébullition de H2Te sera plus
grande que celle de
H2Se. Cette solubilisation d'un composé A ( solide, liquide, gaz) peut être modélisée par : A pur = A dissous. La solubilité du diiode dans l'eau est 0,3 g/L et, à la même température, 140 g/L dans le benzène. Une molécule apolaire ( comme I2) est très soluble dans un solvant apolaire ( benzène) ; par contre une molécule apolaire est peu soluble dans un solvant polaire ( eau). De plus, entre le diiode et le benzène, noyau riche en électrons délocalisés, il s'établit un complexe de transfert de charge ( I2 accepteur d'électrons). Le saccharose, molécule
polaire est soluble dans l'eau, solvant polaire ; le
saccharose, molécule polaire est insoluble dans le
benzène, solvant apolaire.
La mise en solution d'une molécule polarisée d+A--Bd- peut être modélisée par deux étapes successives : étape 1 : ionisation, solvatation : d+A--Bd- = [A+ ....B-] Plus le solvant est polaire, plus il est ionisant. Les solvants du type bases de Lewis ( riches en doublets électroniques) solvatent les cations, déficitaires en électrons. étape 2 : dispersion des ions en solution : [A+ ....B-] = A+(aq) + B-( aq) Des force attractives de Coulomb existent entre la paire d' ions : f = q q' / ( 4pe0er d2) Plus la constante diélectrique er du solvant est importante, plus les ions sont facilement dispersés en solution. Dans le cas de l'eau
er
= 78,4 ; dans le cas de l'acide éthanoïque
e
r = 6,1 : ce solvant
polaire, protique est beaucoup moins dissociant que l'eau.
La basicité ( phénomène thermodynamique : équilibre entre une base et son acide conjugué ) Une base est une espèce susceptible de céder un doublet. La nucléophilie ( phénomène cinétique : mesure de la vitesse d'une réaction entre un nucléophile et un électrophile) aptitude d'une espèce
à attaquer un site déficitaires en
électrons.
HO- > H2 O HO- base plus forte que l'eau ; HO- meilleur nucléophile que l'eau ( basicité est nucléophilie varient souvent dans le même sens) HO- dans le méthanol est comparable à CH3O- dans le méthanol. HO- > (CH3)3CO- cet ion , plus basique que HO- est très encombré. HO- < I- , ce dernier est un ion polarisable, c'est donc un bon nucléophile. |
|||
|
|
|||
|
|