|
concours Agrégation 2005 : le fer : structures cristallines ; oxydes de fer ; sites octaèdrique et tétraèdrique. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
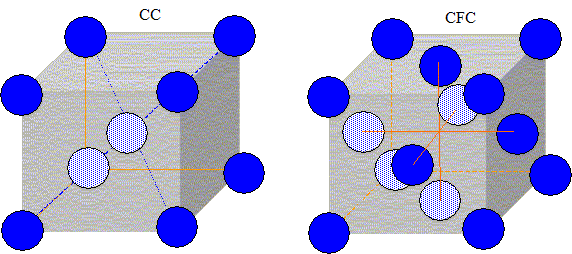
Configuration électronique de l’atome de fer ( Z=26) dans son état fondamental : 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Nature des ions les plus courants de cet élément : Fe2+ 1s2 2s2 2p6 3s2 3p6 3d6 ( perte facile des 2 électrons 4s2) et Fe3+ 1s2 2s2 2p6 3s2 3p6 3d5 ( la couche 3d5 est à moitié pleine). Structure cristalline du fer et du monoxyde de fer : On s’intéresse à deux variétés allotropiques du fer qui existent sous la pression atmosphérique : - pour t < 912 °C, le fer a (Fe a) - pour 912 °C < t < 1538 °C, le fer g (Fe g ). Le fer a cristallise dans un système cubique centré (CC) tandis que le fer g cristallise dans un système cubique à faces centrées (CFC). Représentation des mailles élémentaires de type CC et CFC :
Calcul de la masse volumique théorique des variétés allotropiques du fer a et du fer g. M(fer) = 55,85 g/mol
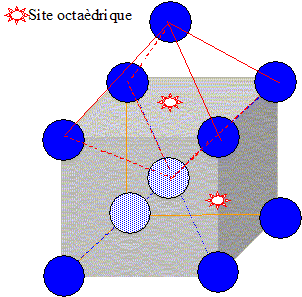
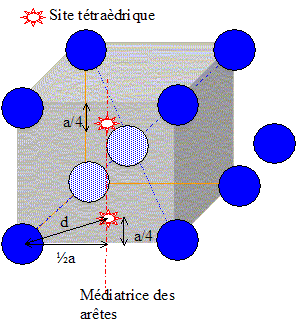
Les atomes de fer sont tangents suivant la grande diagonale du cube, de longueur 3½a = 4 Ra. Ra = 3½a / 4 = 3½ * 287 /4 = 124 pm. Rayon maximum des atomes susceptibles de s’insérer dans chacun des sites après avoir localisé et dénombré ceux-ci :
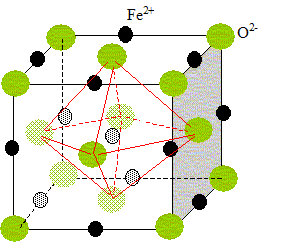
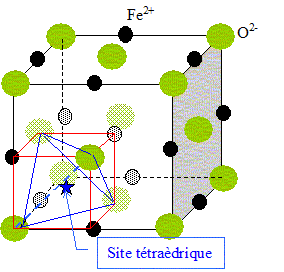
Le fer et le carbone donnent des solutions solides ; or les rayons du fer ( 124 pm) et du carboen (77 pm) sont très différents : ce ne sont pas des olutions solides de substitution. Les rayons des sites tétraèdrique et octaèdrique étant inférieurs à 77 pm, il y a insertion du carbone et déformation de la maille. Le monoxyde de fer, de formule FeO, est un solide ionique qui cristallise dans une structure de type NaCl. L'oxygène dans les oxydes métalliques est sous forme d'ion oxyde O2-. La maille cristalline : les ions oxyde constituant le réseau hôte, les cations occupent les ites octaèdriques avec une coordinence, nombre de plus proches voisins ( anions oxydes) égale à 6.
Nombre de sites octaédriques dans une maille élémentaire CFC : 1 au centre et les milieux de chaque arêtes ( appartenant chacun à 4 maille) : total : 1 + 12/4 = 4 sites octaèdriques. Nombre de sites tétraédriques dans une maille élémentaire CFC : 8 par maille.
On considère la structure dans laquelle la moitié des sites octaédriques sont occupés par des ions Fe3+ ( 2 ions Fe3+ par maille) et 1/8 des sites tétraédriques par des ions Fe2+ ( 1 ion Fe2+ par maille). Ion oxyde : 4 par maille. La formule stoechiométrique de cet oxyde est : Fe3O4. Dimension des sites dans un réseau d'ions O2-CFC non déformé :
Connaissant la masse volumique de cet oxyde( r= 5,18 103 kg m-3), calcul de la valeur de l'arête a de la maille supposée régulière dans tout le réseau. Dans le cas d'un réseau d'ion oxyde non déformé : a =2*2½RO2- = 2*2½*132 = 373 pm ; volume de la maille : V= a3 ; masse de la maille : m = 3 mFe + 4 mO = (3 MFe + 4MO)10-3/NA m =(3*55,85+4*16)10-3 / 6,02 1023 = 3,846 10-25 kg r= m/a3 soit a3 = m/r = 3,845 10-25 / 7,43 103 =2,05 10-29 m3 ; a = 420 pm, valeur supérieure à 373pm, ce qui confirme la déformation du réseau.
|
|||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||