|
Agrégation 2005 : Cinétique de la photo-catalyse par TiO2 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||
| .
. |
|||||||||||||||
|
|||||||||||||||
|
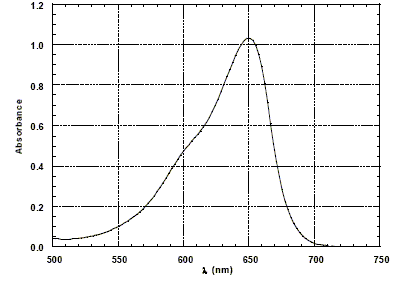
Le solide, sous la forme de très petite particules, est mis en suspension dans la solution à traiter. L'absorption de la lumière par ce semi-conducteur entraîne l'excitation d'un électron qui peut ainsi se déplacer dans le solide et permettre à des réactions d'oxydoréduction de se produire avec les molécules organiques adsorbées à la surface de la particule. Le bilan de ce processus complexe est en fait une oxydation des molécules organiques par le dioxygène présent en solution. La photo-décomposition d'une substance organique est considérée complète si les produits de la réaction sont CO2, NO3-, SO42- et H2O, selon la nature des éléments chimiques contenus dans la molécule organique de départ. On parle alors de minéralisation totale du polluant. Afin de mieux comprendre les mécanismes mis en jeu dans la photo-décomposition on utilise des molécules modèles comme des colorants organiques. La solution contenant le colorant et la suspension de TiO2 est éclairée par une lampe UV et est laissée au contact de l'air afin de maintenir la concentration en dioxygène constante. On se propose d'analyser les résultats obtenus avec le rouge de Congo, l'alizarine S et le bleu de méthylène. L'activité du dioxyde de titane pour la photo-décomposition n'est significative que si la taille des particules est inférieure à 100 nm (en diamètre). Le catalyseur solide réagit avec les espèces adsorbées à sa surface ; celle-ci doit être la plus grande possible ; la surface de contact est d'autant plus grande que la dimension des particules de TiO2 est plus petite. La concentration en colorant est mesurée par la technique de l'absorption UV-visible d'un prélèvement de la solution au cours de la réaction. La figure ci-dessous donne le spectre d'absorption du bleu de méthylène en solution dans l'eau.
Longueur d'onde utilisée pour faire l'étude cinétique dans le cas du bleu de méthylène : On choisit la longueur d'onde pour laquelle l'absorption est maximale soit 650 nm. Dans ces conditions les mesures sont les plus précises. D'autre part l'absorbance ne varie pratiquement pas si la longueur d'onde subit de petites variations. Loi de Beer-Lambert : Dans le cas des solutions, la loi de Beer fait intervenir les concentrations. I = I0 . e (- elc) où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L). Cette loi est vérifiée lorsque la solution est de concentration inférieure à : c < 0,1 mol.L-1. La relation fondamentale utilisée en spectrophotométrie est présentée sous la forme : A= log (I0/I) = elc ( A est l'absorbance ou densité optique) Si cette loi s'applique, on peut effectivement suivre la cinétique de la réaction de photo-décomposition par la mesure de l'absorbance d'un prélèvement. On précise que tous les produits de cette décomposition sont incolores.
L'absorbance A est proportionnelle à la concentration du colorant ; A=e l [colorant] ; la vitesse de la réaction est : v = dev/dt = - d[colorant]/dt = - (e l)-1 dA/dt , avec ev avancement volumique. On s'intéresse au cas du bleu de méthylène dont la formule brute est C16H18N3S+,Cl-. La formule développée est donnée : 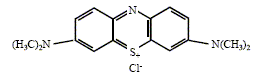
Equation de la minéralisation totale de ce colorant : C16H18N3S+,Cl- + 25,5O2 = 16CO2+ 3NO3- + SO42- + 6 H2O + Cl- + 6 H+. Cette réaction ne peut pas être un processus élémentaire : un processus élémentaire met en oeuvre un petit nombre de molécules, ce qui n'est pas le cas de la réction ci-dessus. En supposant que cette réaction admet un ordre par rapport à chaque réactif, l'expression générale de la vitesse de disparition du bleu de méthylène est : v = k[colorant]a[O2]b.
|
|||||||||||||||
|
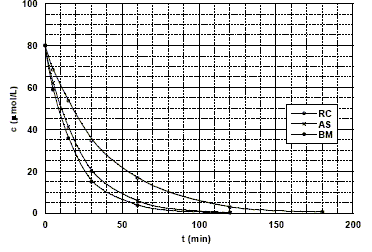
La figure ci-dessous donne l'évolution au cours du temps de la concentration en colorant pour les trois expériences étudiées :
étude cinétique de la photo-décomposition du rouge de Congo (RC), de l'alizarine S (AS) etdu bleu de méthylène (BM) en présence de TiO2 à la température de 293 K. Pour tous les colorants, la concentration à t = 0 est égale à 80 mmol/L. Le tableau ci-dessous donne
l'évolution de la concentration en colorant en
fonction du temps dans le cas
du bleu de méthylène.
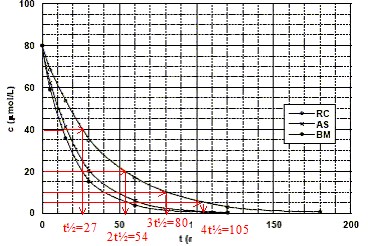
Montrons graphiquement, à partir de cette figure, que la réaction est du premier ordre. On prendra le cas du rouge de Congo pour illustrer cette méthode. réaction d'ordre 1 : le temps de demi réaction est indépendant de la concentration ; à chaque t½ la concentration en colorant est divisée par deux.
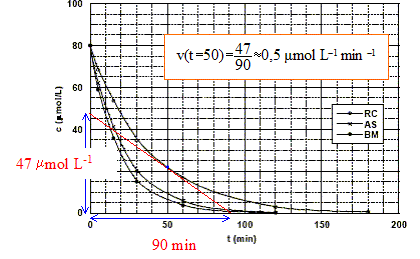
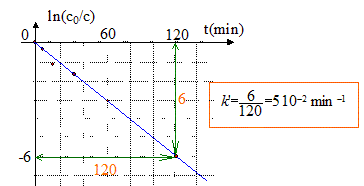
À partir des données du tableau, vérifions par une autre méthode, que cette hypothèse est juste dans le cas du bleu de méthylène : v = k[colorant][O2] = k'[colorant] avec k'= k[O2] si [O2] en excès peut être considéré comme constant. d[colorant]/dt = - k'[colorant] soit après intégration c = c0 exp(-k't) ou bien ln (c0/c) = k't. On trace le graphe ln (c0/c) = f(t) droite de pente k' si l'hypothèse est vérifiée.
Le temps de demi-réaction de la réaction de décomposition du bleu de méthylène dans les conditions de l'expérience est : t½ = ln2 / k' = ln2 / 0,05 = 14 min.
|
|||||||||||||||
|
|