|
Agrégation 2005 : la métallurgie du titane ; diagramme d'Ellingham ; avancement, pression partielle En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
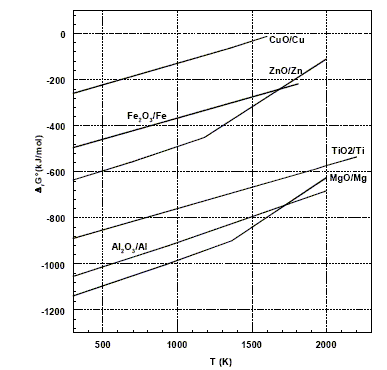
(1) TiO2(s) + 2Cl2(g) + 2C(s) = 2CO(g) + TiCl4(g) à 900°C (2) TiCl4(g) + 2Mg(l) = Ti(s)+ 2MgCl2(l) à 800°C On obtient ainsi le métal titane sous la forme d'éponge qui est ensuite refondue pour obtenir des lingots. La figure ci-dessous donne le diagramme d'Ellingham, rapporté à 1 mol de dioxygène, pour quelques composés.
Principe de construction du diagramme d'Ellingham : On représente l'enthalpie libre DrG°(T) de la réaction suivante en fonction de la température. 2x/y M+ 1 O2 =2/y MxOy. L'entropie DrS° et l'enthalpie DrH° étant supposées indépendantes de la température, les courbes d'équation DrG°(T) = DrH° - T DrS° sont des segments de droites. Les ruptures de pente correspondent à des changements d'états physiques. Prévision du sens d'évolution d'une réaction chimique à l'aide des couples Fe2O3/Fe et Al2O3/Al : 4/3 Al + O2 = 2/3Al2O3 (1) DrG°1. 4/3 Fe + O2 = 2/3Fe2O3 (2) DrG°2. 1, 5 fois (1) - 1,5 fois (2) donne : Fe2O3 + 2Al = 2Fe + Al2O3 DrG° avec DrG° = 1,5 ( DrG°1-DrG°2) Dans le domaine de température proposé, la droite relative à Al2O3/Al est située au dessous de la droite relative à Fe2O3/Fe : en
conséquence : DrG°1<DrG°2
et DrG°
<0, la réaction évolue dans le sens direct,
réduction de Fe2O3.
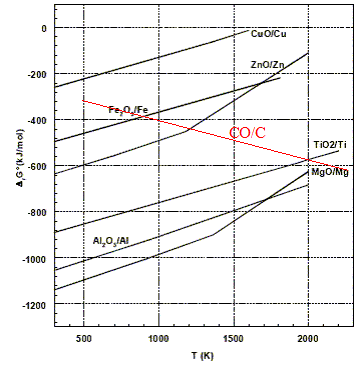
Courbe d'Ellingham pour ce couple dans le domaine de température 500-2000 K ajoutée sur la figure ci-dessus : DrH° = 2DrH°(CO)-DrH°(O2(g))-2DrH°(C graphite ) = -221 kJ/mol DrS° = 2DrS°(CO)-DrS°(O2(g))-2DrS°(C graphite ) = 2*197,6 -2*5,7-205 = 178,8 J mol-1 K-1. DrG °=DrH° -TDrS° = -221 -0,1788 T en kJ/mol. DrG °(500) = -310 kJ/mol ; DrG °(2000) = -579 kJ/mol ;
La réduction de
TiO2 par C est possible si la température
est supérieure à 2000 K (
température d'inversion de
cette réaction).
(1) TiO2(s) + 2Cl2(g) + 2C(s) = 2CO(g) + TiCl4(g) à 900°C En utilisant l'approximation d'Ellingham, montrons que cet équilibre est favorisé dans le sens direct quelque soit la température.
DrH° = -763 -2*110,5 +945 = -39 kJ/mol DrS° = DrS°(TiCl4) +2DrS°(CO)-2DrS°(Cl2(g)-2DrS°(C graphite )- DrS°(TiO2) DrS° = 354,8+2*197,6 -2*223-2*5,7 -50,3= 242 J mol-1 K-1. DrG °=DrH° -TDrS° = -39 -0,242 T en kJ/mol. DrG °<0 quelque soit T : l'équilibre (1) est favorisé dans le sens direct. On une température de 900°C, qui est une température intermédiaire en métallurgie car : - La température est un facteur cinétique favorable. - La réaction étant exothermique, à plus haute température, l'équilibre serait déplacé dans le sens indirect. On peut séparer le chlorure de titane du mélange réactionnel à la suite de cette première étape en abaissant la température à une valeur inférieure à 136 °C, température d'ébullition de TiCl4. Les autres constituants du mélanges étant soit solide, soit gazeux.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(3) TiCl4(g) + O2(g) = TiO2(s) + 2Cl2(g) à 1400°C On étudie cet équilibre à la température de 1400°C à laquelle la constante d'équilibre vaut K' = 230. Le volume total de l'enceinte est de 100 L. On part d'un mélange formé de 2 mol de chacun des réactifs TiCl4 et O2. Quantités de matière
de tous les constituants ainsi que les pressions partielles
des gaz à l'équilibre : xéq
= 1,77 mol 0,23 0,23 1,77 3,54 A l'équilibre : nombre total de mol de gaz N= 4 fractions molaires des gaz : x(TiCl4) = x(O2) =(2-xéq)/N ; x(Cl2) =2xéq /N Les pression partielles sont proportionnelles aux fractions molaires ; P: pression totale. P(TiCl4) =P(O2)= (2-xéq)P/N ; P(Cl2) =2xéq P/N d'où K'= [(2xéq) / (2-xéq)]2 = 230 ; (2xéq) / (2-xéq) = 230½ =15,16 2xéq = 15,16(2-xéq) ; xéq = 1,77 mol. P= NRT/V = 4*8,314*(1400+273) / 0,1 =5,56 105 Pa = 5,56 bars. P(TiCl4) =P(O2)= (2-xéq)P/N = 0,23*5,56/4 = 0,32 bar P(Cl2) =2xéq
P/N =2*1,77*5,56/4 =4,91
bars
Composition du système lorsqu'il n'évolue plus.
A l'équilibre : nombre total de mol de gaz N= 20 fractions molaires des gaz : x(TiCl4) = x(O2) =xéq/N ; x(Cl2) =(20-2xéq) /N Les pression partielles sont proportionnelles aux fractions molaires ; P: pression totale. P(TiCl4) =P(O2)= xéqP/N ; P(Cl2) =(20-2xéq) P/N d'où K'= [(20-2xéq) / xéq]2 = 230 ; (20-2xéq) / xéq = 230½ =15,16 15,16 xéq = 20-2xéq ; xéq = 1,16 mol. xéq ne peut pas être supérieur à xmax =1 ; il n'y a pas d'équilibre, la réaction est totale. Effet d'une variation de pression totale, à composition constante et température constante, sur l'équilibre (3) : Dans l'expression de K', la
pression n'apparaît pas, seul l'avancement y figure :
une variation de pression ne modifie pas l'équilibre.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|