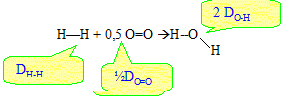|
Principe de la pile à combustible : concours général physique 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||
| .
. |
||||||||||||||
|
||||||||||||||
|
Il s'agit de réaliser la réaction de synthèse de l'eau : H2 + ½O2 --> H2O Soit une molécule contenant des liaisons A--B entre les atomes A et B. Par définition l'énergie de liaison DA-B est l'énergie qu'il faut fournir pour dissocier une mole de liaisons A--B et ainsi séparer les atomes A et B à l'état gazeux. C'est également l'énergie libérée lors de la formation d'une mole de liaison A-B à partir des atomes A et B pris séparément à l'état gazeux. On donne dans le tableau ci-dessous les énergies de liaisons ( à 25°C pour des composés à l'état gazeux) :
Energie libérée, notée q, lors de la synthèse d'une molécule d'eau :
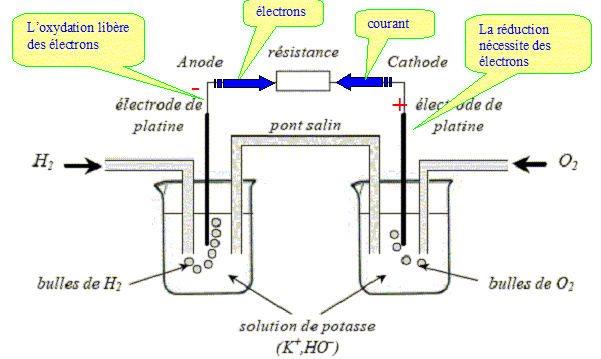
q= DH-H + 0,5 DO=O -2DO-H q= 432+0,5 *494 -2*460 = -241 kJ mol-1. q est négatif : de l'énergie est libérée vers l'extérieur ; la réaction est exothermique. C'est une source d'énergie non polluante car elle ne produit que de l'eau. Lorsqu'on mélange directement les gaz H2 et O2, dans des proportions stoechiométriques et que l'on initie la réaction par une étincelle, on observe une violente explosion qui libère d'un coup toute l'énergie de la réaction sous forme thermique. Dans la pile à combustible ( ou pile à hydrogène) de laboratoire, on évite le contact direct entre les réactifs en utilisant des électrodes de platine et un pont électrolytique.
à l'anode négative, oxydation de H2 : H2 + 2HO- = 2H2O + 2e- (1) à l'cathode positive, réduction de O2 : ½O2 + 2e- +H2O = 2HO-(2) Bilan : (1) + (2) donne H2 +½O2 = H2O L'énergie de la réaction est libérée sous forme électrique grâce à la circulation d'un courant électrique dans le circuit. Rôle du pont électrolytique formé par un gel ionique NH4+ + NO3- : il assure la continuité électrique entre les deux solutions. Il permet aux solutions de chaque bécher de rester électriquement neutre : migration des ions NH4+ vers la cathode et NO3- vers l'anode.
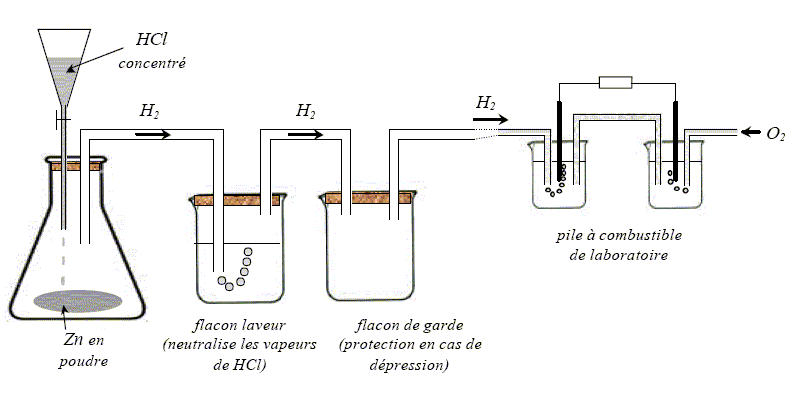
Etude expérimentale d'une pile de laboratoire Le dioxygène provient directement d'une bouteille de stockage. le dihydrogène est fabriqué in situ à l'aide d'une réaction d'oxydoréduction de l'acide chlorhydrique concentré HCl sur le zinc Zn ( de masse molaire MZn = 65,4 g/mol). Production de H2 : l'acide chlorhydrique est ajouté goutte à goutte dans un erlenmeyer contenant du zinc en poudre. La réaction qui s'y produit est exothermique et libère le dihydrogène H2 : Oxydation du zinc : Zn = Zn2+ + 2e-. réduction de H+ : 2H+ + 2e- = H2 Bilan : Zn +2H+ = Zn2+ + H2
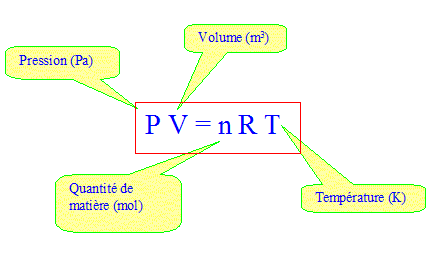
Le gaz passe dans un flacon laveur et dans un flacon de garde avant d'arriver à l'anode de la pile à combustible. Le débit de H2 peut être évalué en comptant le nombre de bulles par seconde qui arrivent à l'anode. On règle le débit à DH2 = 10 bulles par seconde. Quantité de H2 contenue dans une bulle : Une bulle de H2 mesure d= 2,0 mm de diamètre au moment où elle éclate à la pression atmosphérique P0 = 1,0 105 Pa. On assimile le dihydrogène à un gaz parfait à la température ambiante T= 293 K. On donne la constante des gaz parfaits R= 8,31 J mol-1 K-1.
V= 4/3 p r3 avec r = 10-3 m ; V= 4/3*3,14 10-9 = 4,187 10-9 m3 n = PV/ (RT) = 105*4,187 10-9 / (8,31*293) = 1,7 10-7 mol (1,719 10-7) Quantité de H2 libérée en 10 minutes : 1,719 10-7 * 10*600 = 1,0 10-3 mol. Masse de Zn nécessaire : Zn +2H+ = Zn2+ + H2 donne : n(Zn )= n(H2)= 1,0 10-3 mol masse (g) = quantité de matière (mol) * mase molaire (g/mol) 1,0 10-3 * 65,4 = 6,5 10-2 g. Débit de dioxygène à la cathode : le dioxygène et le dihydrogène doivent être apportée dans des proportions stoechiométriques. On suppose que les bulles de H2 et O2 ont la même taille. H2 +½O2 = H2O donne n(O2 )= ½n(H2)d'où DO2 = ½DH2 = 5 bulles par seconde.
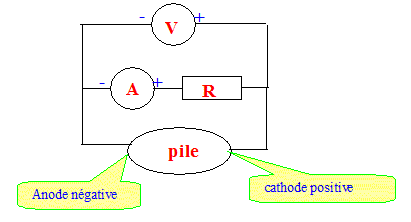
Intensité maximale I que pourrait débiter cette pile : On donne le nombre d'Avogadro NA = 6,02 1023 mol-1 et la charge élémentaire e= 1,6 10-19 C. Quantité de matière d'électrons apparaissant à l'anode en 1 s : H2 + 2HO- = 2H2O + 2e- donne n(e-) = 2 n(H2) = 2* 1,719 10-7 * 10 = 3,436 10-6 mol. Quantité d'électricité correspondante : Q = n(e-) NA e = 3,436 10-6*6,02 1023*1,6 10-19 = 0,33 C. Intensité maximale I = Q/t avec t = 1 s. I = 0,33 A. Schéma électrique permettant de mesurer l'intensité I et la tension U aux bornes de la pile :
Puissance théorique P de notre pile : La tension aux bornes de la pile à combustible fait intervenir les couple oxydant / réducteur O2/HO- et H2O/H2 et vaut en théorie U = 1,23 V. Si la pile délivre l'intensite I= 0,33 A, alors P= U I = 1,23*0,33 = 0,41 W ou 0,41 J s-1. Quantité de matière d'eau formée en 1 s : H2 +½O2 = H2O donne n(H2 )= n(H2O) = 1,7 10-6 mol en 1 s. Energie électrique par mole d'eau formée : 0,41 / 1,7 10-6 = = 2,4 105J mol-1 = 2,4 102J mol-1. Cette énergie correspond à la conversion de l'énergie chimique lors de la formation de l'eau en énergie électrique. Rendement expérimental : En réalité on mesure U = 0,20 V pour I = 20 mA Puissance électrique expérimentale : 0,20*20 10-6 = 4,0 10-6 W. rendement : 4 10-6/0,41 voisin de 10-5 ( valeur très faible)
Dans la réalité, le pont salin est remplacé par des membranes échangeuses de protons, de grande conductivité électrique. |
||||||||||||||
|
|
||||||||||||||
|
|