|
chimie : quantité de matière (mole), tableau d'avancement En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Une bouteille de vinaigre de volume v= 70 cL porte sur son étiquette l'indication 8°: cela signifie que 100 g de vinaigre contient 8 g d'acide éthanoîque. Données : Masse volumique du vinaigre :r=1,00 kg/L ; C : 12 ; O : 16 ; H : 1 g/mol.
70 cL= 0,7 L ; m = 0,70 *1 = 0,70 kg = 700 g. Masse d'acide éthanoïque : 8 g dans 100 g de vinaigre donc 7*8 = 56 g. Masse molaire de l'acide éthanoïque : M= 2*12+4+2*16 = 60 g/mol. Quantité de matière d'acide éthanoïque n = m/M = 56 / 60 = 0,93 mol. Nombre de molécules : 1 mol correspond à NA= 6,02 1023 molécules. 0,93 * 6,02 1023 =5,6 1023 molécules. Quantité de matière d'acide acétique est contenue dans une petite cuillère : 8 g d'acide dans 100 mL soit 8*3/100 = 0,24 g dans la petite cuillère. n = 0,24 / 60 = 4,0 10-3 mol.
si NH3 est en défaut : 100-4xmax=0 soit xmax = 100/4 = 25 Retenir la plus petite valeur xmax =16 mol.
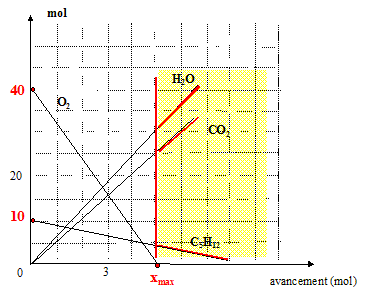
La zone en jaune est dite " abusive " ; aucune portion de droite ne doivent y être tracées. ( le dioxygène étant en défaut, la réaction chimique s'arrête) Compléter le tableau d'avancement à partir de ces courbes :
si C5H12 est en défaut : 10-xmax=0 soit xmax = 10 Retenir la plus petite valeur
xmax =5
mol.
2Al + 3S = Al2S3. Construire le tableau d'avancement ; en déduire xmax, l'avancement maximal. Calculer la masse de sulfure d'aluminium Al2S3 formé et la masse du réactif en excès.
si S est en défaut : 9,4 10-2 -3xmax =0 soit xmax =9,4 10-2 /3 =3,1 10-2 . Retenir la plus petite valeur xmax = 3,1 10-2 mol. masse de sulfure d'aluminium Al2S3 formé : m= n M. M=2*27+3*32 = 150 g/mol ; m = 3,1 10-2 *150 = 4,6 g. masse du réactif en excès : m= n M. M = 27 g/mol ; m = 0,012*27 =
0,32
g.
Combustion d'une masse m =700 g d'heptane C7H16, liquide de masse volumique r= 0,78 g/mL. Le volume molaire des gaz est Vm = 25 L/mol. C7H16 + 11 O2 = 7CO2 + 8H2O. Volume d'heptane (mL) = masse (g) / masse volumique ( g/mL) V = 700/0,78 = 897 mL ( réponse 9,0 102 mL) Quantité de matière d'heptane (mol) = masse (g) / masse molaire (g/mol) M= 7*12+16 = 100 g/mol n = m/M = 700/100 = 7 mol. Tableau d'avancement et composition finale du système ( les réactifs étant mélangés en proportions stoechiomètriques).
O2 est en défaut :n -11xmax =0 soit n=11xmax =11*7 = 77 mol. volume de O2 nécessaire = n Vm = 77*25 =1,9 103 L. Masse d'eau : m= nM avec M= 18 g/mol m = 56*18 =1,0 103 g. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|