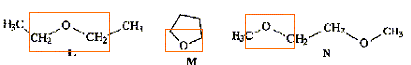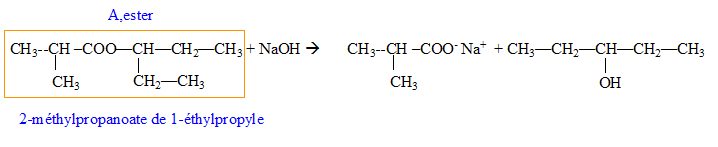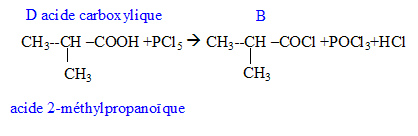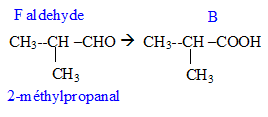|
chimie organique de base, RMN, réaction de condensation concours assistant chimiste 2005 Alsace En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
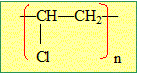
éthylène C2H4. M= 2*12 +4 = 28 g/mol Quel est le nom de ce composé ? 1 pt.
Une macromolécule d'indice de polymérisation n = 2500 a une masse molaire M= 105 kg /mol. Quelle est la masse molaire du monomère ? 1 pt. 105 000 / 2500 = 42 g/mol. Quellle est la formule du PVC ? 1 pt.
Le pH d'un composé organique de concentration c=0,5 mol/L vaut 2,6. Dites si ce composé est : 1 pt. un acide fort , une base faible, une base forte, un acide faible. Le pH est inférieur à 7 ( à 25 °C) : donc c'est un acide. Le pH est supérieur à -log c = -log 0,5 =0,3 : c'est un acide faible. Les équations bilan ci-dessous correspondent respectivement aux types de réactions suivantes : Dire quelle colonne correspond aux bonnes réactions : 1 pt.
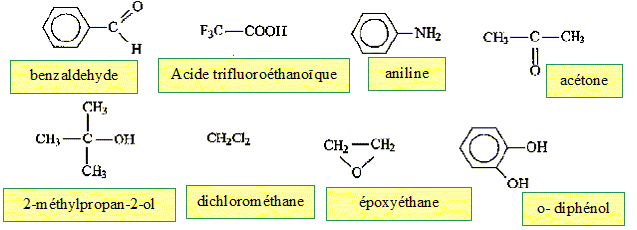
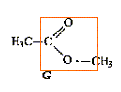
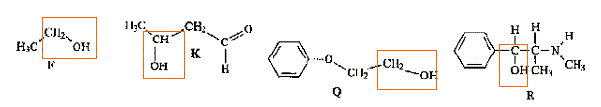
Parmi les molécules ci-dessous :
des amines
: des éthers
: des esters
: des acides :
des alcools :
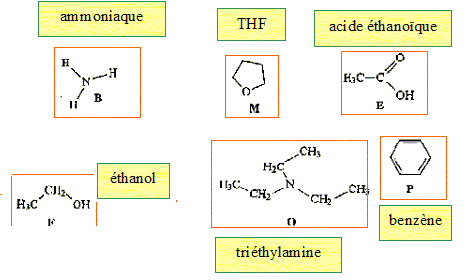
Retrouver les formules correspondants à : l'ammoniaque, l'acide écétique, le benzène, le tétrahydrofuranne, l'éthanol, la triéthylamine.
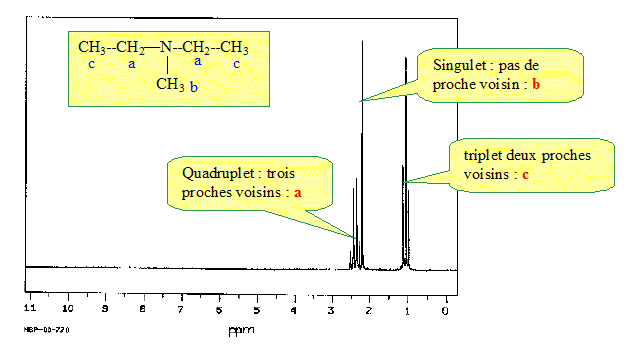
Attribuer à chaque groupe hydrocarboné le ou les signaux correspondants 5 pts.
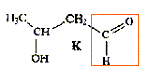
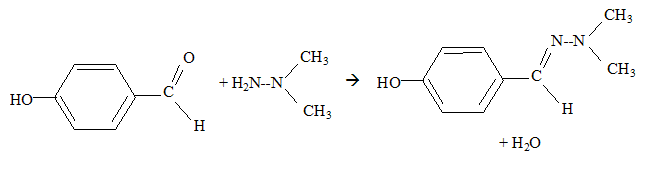
Une réaction de condensation a lieu entre ces deux réactifs. Quelle est la masse moalire de leur produit de réaction ? 3 pts.
M= 60+122-18 = 164 g/mol. Le rendement de la réaction est de 67% en produit isolé. Si l'on veut obtenir 11 g de produit final, combien de 1,1 diméthylhydrazine faut-il utiliser ? 1 pt. masse théorique de produit : m= 11/0,67 = 16,42 g Quantité de matière théorique de produit : n = m/M = 16,42/164 =0,10 mol Quantité de matière de 1,1-diméthylhydrazine : 0,10 mol masse : 60*0,1 = 6,0 g.
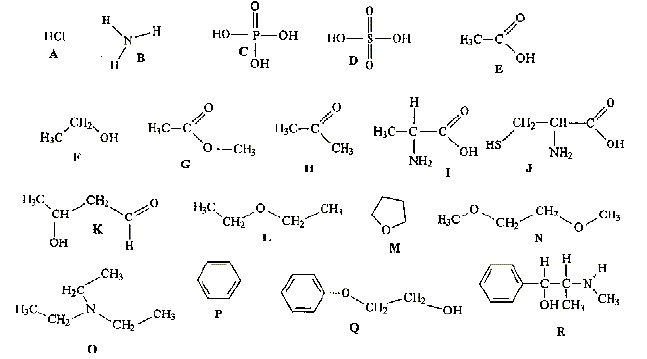
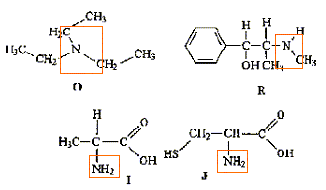
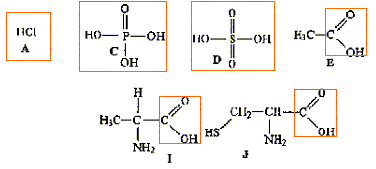
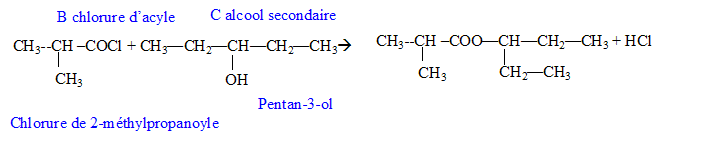
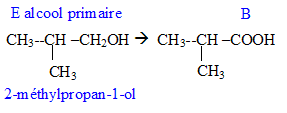
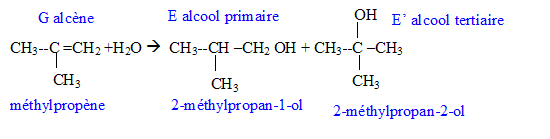
Donner la formule semi-développée, le nom, la famille et le cas échéant la classe des composés A, B, C, D, E, F, G. 12 pts.
B + C--> A + HCl.
D + PCl5-> A + POCl3+HCl.
E --> B. oxydation par Cr2O72- en excès
F--> B. oxydation par Cr2O72- dilué.
G + H2O --> E + E' majoritaire, en présence H2SO4.
|
|||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||
|
|
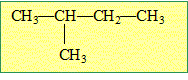 2-méthylbutane.
2-méthylbutane.