|
Titrage iodométrique d'une solution aqueuse d'acétone concours technicien laboratoire 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
Principe de la manipulation : L'acétone réagit avec le diiode en milieu basique selon la réaction d'équation : CH3-CO-CH3(aq) + 3 I2(aq) + 4 HO-(aq) = CH3-COO-(aq) + 3H2O(l) + CHI3(s) + 3I-(aq) On travaille avec un excès de diiode. Après avoir acidifié le milieu, le diiode n'ayant pas réagi est dosé par les ions thiosulfate en présence d'empois d'amidon. Mode opératoire : Dans un erlenmeyer on verse V= 10,0 mL de la solution d'acétone, V1 = 20,0 mL d'une solution de diiode de concentration molaire volumique c1 = 1,00 10-1 mol/L et 5 mL d'une solution aqueuse d'hydroxyde de sodium à 5 mol/L. On bouche l'erlenmeyer et on agite pendant quelques minutes. Il se forme alors un précipité jaune de triiodométhane CHI3(s).
Le volume V1 de diiode doit être très précis : on utilise une pipette jaugée de 20,0 mL. Le volume de solution d'hydroxyde de sodium est peu précis ( 5 mL) : on utilise une éprouvette graduée de 25 mL. Le diiode I2 est très peu soluble dans l'eau, à cause des interactions de type van der WAALS peu favorables (molécule "apolaire" de diiode et solvant "polaire" l' eau ). La solubilité du diiode dans l'eau est augmentée si on utilise un agent complexant du diiode, l' iodure de potassium KI. Les molécules de diiode forme alors l' anion triiodure, I3- selon la réaction équilibrée : I2 + I- = I3-
- dismutation du diode en ion iodure I- (aq) et en ion iodate IO3- (aq) en milieu basique 3I2 (aq) + 6 HO-(aq)= 5 I-(aq) + IO3- (aq) + 3H2O(l) (1) - réaction entre les ion iodate et l'acétone : CH3-CO-CH3(aq) + IO3- (aq) + 2 I-(aq) = CH3-COO-(aq) +2 HO-(aq)+ CHI3(s) (2) - (1) est une réaction d'oxydoréduction. Retrouver les deux demi-équations électroniques. Le mode opératoire parle de dismutation du diode pour la réaction (1). Que signifie ce terme ? Montrer qu'il y a bien dismutation dans la réaction (1). réponse : couple oxydant réducteur : I2 (aq) / I-(aq) I2 (aq) + 2e- = 2 I-(aq) ; le diiode joue le rôle d'oxydant qui se réduit. couple oxydant réducteur : IO3- (aq) /I2 (aq) I2 (aq) +12HO-(aq)= 10e- +2 IO3- (aq) + 6H2O(l) ; le diiode joue le rôle de réducteur qui s'oxyde. Le diiode joue un double rôle : il s'agit bien d'une dismutation.
Après 15 min, on acidifie le milieu en versant 20 mL de solution aqueuse d'acide sulfurique à 2 mol/L. On transforme alors les ions I-(aq) et IO3- (aq) qui n'ont pas réagi en diiode : 5 I-(aq) + IO3- (aq) + 6H+(aq) = 3I2 (aq) + 3H2O(l). On dose alors le diiode qui n'a pas réagi par une solution de thiosulfate de sodium de concentration molaire volumique c2 = 1,00 10-1 mol/L. L'équation de la réaction support du dosage s'écrit : I2 (aq) + 2S2O32-(aq) = 2 I-(aq) +S4O62-(aq) L'une des caractéristiques de la transformation
associée à la réaction
étudiée est qu'elle doit être totale.
Vérifier cela, en calculant la constante
d'équilibre K associée à
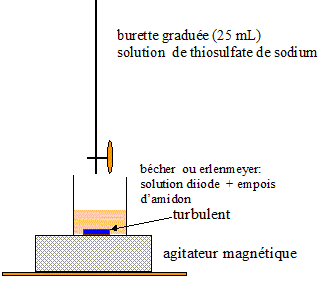
l'équation de cette réaction. Comment repère t-on l'équivalence ? Faire le schéma annoté du dispositif pour réaliser ce titrage. réponse : I2 (aq) + 2S2O32-(aq) = 2 I-(aq) +S4O62-(aq) ; K = [I-(aq)]2[S4O62-(aq)] / ([S2O32-(aq)]2[I2 (aq)]). couple S4O62-(aq) / S2O32-(aq) : S4O62-(aq) + 2e- = 2 S2O32-(aq) E1 = E° ( S4O62-(aq) / S2O32-(aq) ) + 0,03 log ([S4O62-(aq) ] /[S2O32-(aq)]2 ) couple I2 (aq) / I-(aq) : I2 (aq) + 2e- = 2 I-(aq) E2 = E° ( I2 (aq) / I-(aq) ) + 0,03 log (I2 (aq) /[I-(aq)]2 ) A l'équilibre : E1 = E2 ; E° ( S4O62-(aq) / S2O32-(aq) ) + 0,03 log ([S4O62-(aq) ] /[S2O32-(aq)]2 ) = E° ( I2 (aq) / I-(aq) ) + 0,03 log ([I2 (aq)] /[I-(aq)]2 ) 0,03 log ([S4O62-(aq) ] /[S2O32-(aq)]2 ) - 0,03 log ([I2 (aq)] /[I-(aq)]2 ) = E° ( I2 (aq) / I-(aq) ) - E° ( S4O62-(aq) / S2O32-(aq) ) 0,03 log ([S4O62-(aq) ][I-(aq)]2 / ([S2O32-(aq)]2[I2 (aq)]) ) = 0,62-0,09 = 0,53 0,03 log K = 0,53 ; log K = 0,53/0,03 = 17,7 ; K = 4,6 1017. K étant très grand, la réaction est totale. On repère l'équivalence par le changement de teinte de l'empois d'amidon ( indicateur coloré).
|
|
|
On trouve VE= 10,8 mL. Calculer c. Claculer la masse d'acétone présente dans un litre de solution et comparer avec la valeur indiquée sur la bouteille ( M( acétone) = 58,1 g/L ) réponse : initiale : V1c1 = 20,0 10-3*1,00 10-1 = 2,00 10-3 mol en excès : I2 (aq) + 2S2O32-(aq) = 2 I-(aq) +S4O62-(aq) d'où n(I2) excès = ½n(S2O32-) = 0,5 VEc2 = 0,5 * 10,8,0 10-3*1,00 10-1 = 5,40 10-1 mol ayant réagit avec l'acétone : V1c1 - 0,5 VEc2 = (2,00-0,540) 10-3 = 1,46 10-3 mol. CH3-CO-CH3(aq) + 3 I2(aq) + 4 HO-(aq) = CH3-COO-(aq) + 3H2O(l) + CHI3(s) + 3I-(aq) n( acétone) =n( diiode) / 3 = (V1c1 - 0,5 VEc2 ) / 3= 1,46 10-3 / 3 = 4,87 10-4 mol n( acétone) = Vc ; c = (V1c1 - 0,5 VEc2 ) /( 3V)= 4,87 10-4 / 0,010 =4,87 10-2 mol/L. masse d'acétone présente dans 1 L : 4,87 10-4 * 58,1 = 2,83 g/L. écart relatif ( 3-2,83) / 3 =0,057 (5,7 %) A 6 % près, accord avec l'indication de l'étiquette.
|
|
|
|