|
concours électroradiologie médicale électrolyse à anode soluble, acide benzoïque. Poitiers 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||
| .
. |
||||||||||||||||
|
||||||||||||||||
|
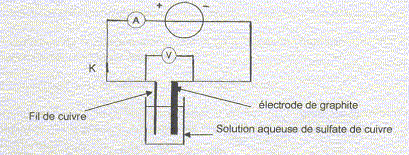
Pour étudier le principe de cette électrolyse, on réalise l'expérience suivante schématisée ci-dessous. Dans un becher de 250 mL contenant une solution aqueuse de sulfate de cuivre ( Cu2+(aq) + SO42-(aq) de concentration molaire volumique égale à 0,1 mol/L acidifiée par de l'acide sulfurique (2H+(aq) + SO42-(aq)), on dispose une électrode de graphite ( inerte chimiquement pour l'électrolyse étudiée) et un fil de cuivre de masse m.
On donne les couples oxydant/réducteur des couples contenus dans l'électrolyseur : H2O (l) / H2(g) ; O2(g) / H2O (l) ; H+(aq) / H2(g) ; S2O82-(aq)/ SO42-(aq) ; Cu2+(aq)/Cu(s). La masse molaire du cuivre est 63,5 g/mol ; 1 F= 96 500 C/mol. On réalise l'électrolyse à intensité I constante. La tension est réglée à 0,30 V. Au bout d'une durée Dt on arrête l'électrolyse, on sort le fil de cuivre de l'électrolyseur, on le sèche et on le pèse : soit m' la masse obtenue, on a m'<m. D'autre part on observe au fond de l'électrolyseur la formations de boues constituées d'impuretés insolubles et enfin, l'électrode de graphite s'est recouverte d'une fine couche de cuivre légérement rosée. Il n'y a pas eu de dégagement gazeux et les ions sulfates ne réagissent pas.
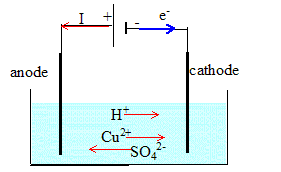
A la cathode négative, l'oxydant Cu2+ gagne des électrons et se réduit. Cu2+ (aq) +2e- = Cu(s) A l'anode positive, un réducteur ( le métal de l'anode ) s'oxyde en cédant des électrons Cu(s) = Cu2+ (aq) +2e-. Quantité d'électricité Q qui traverse le circuit extérieur pendant Dt = 15 min. Q= IDt = 1,5*15*60 = 1350 C Tableau d'avancement
décrivant la réaction
cathodique
: n(e-) = IDt / F = 2x x= n(Cuformé) =
IDt/
(2F). masse (g) = quantité de matière (mol) * mase molaire (g/mol) m =n(Cuformé)
M(Cu) =IDt/
(2F) * M(Cu) = 1350*63,5/(2*96500) =0,44 g.
L'acide benzoïque C6H5-COOH est un solide blanc, peu soluble dans l'eau : solubilité à 25 °C s= 2,5 g/L. M= 122 g/mol. couple acide base : acide benzoïque / ion benzoate : C6H5-COOH / C6H5-COO- pKa = 4,2 à 25°C. L'acide benzoïque peut être utilisé comme conservateur dans les boissons de type soda.
Equation de la réaction modélisant la transformation chimique qui a lieu lors de la mise en solution de l'acide benzoïque dans l'eau. C6H5-COOH + H2O =
C6H5-COO- +
H3O+. Ka =
[C6H5-COO-][H3O+]
/ [C6H5-COOH] [ C6H5-COOH ]/[C6H5-COO-] = [H3O+] / Ka = 10-3 / 10-4,2 = 101,2=15,8. La forme acide du couple acide base prédomine à pH=3. Ce résultat était prévisible en raisonnant sur le domaine de prédominance des espèces chimiques du couple C6H5-COOH / C6H5-COO- : à pH < pKa, la forme acide prédomine. Equation de la réaction modélisant la transformation chimique qui a lieu lors du titrage : C6H5-COOH (aq)+ HO-(aq) = C6H5-COO- (aq) + H2O. A l'équivalence V1c1 = V2c2 ; c1 = V2c2/ V1= 20*0,01/10 = 0,020 mol/L titre massique en acide benzoïque (g/L) = concentration molaire (mol/L) * masse molaire (g/mol) 0,020*122 = 2,4 g/L, résultat compatible ( inférieure à s) avec la solubilité s ( 2,5 g/L à 25 °C) Equation de la réaction modélisant la transformation chimique qui a lieu lors de la synthèse : C6H5-COOH + C6H5-CH2-OH = C6H5-COO-CH2-C6H5 + H2O. estérification, lente, athermique, limitée par l'hydrolyse de l'ester.
|
||||||||||||||||
|
|
||||||||||||||||
|
|