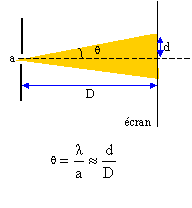
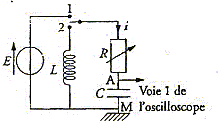
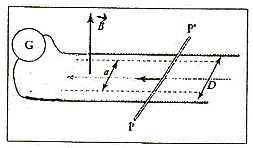
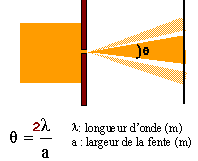|
d'après
concours
manipulateur électroradiologie médicale
Montpellier 2006 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
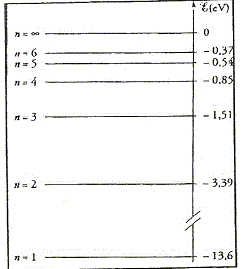 - Le niveau d'énergie nulle est le plus stable.
faux
( l'énergie nulle
correspond à l'atome ionisé ) - L'atome d'hydrogène peut absorber un photon de longueur d'onde l=1881 nm. exact. ( Energie du photon E=
hc/l
= 6,63 10-34*3 108 / 1,881
10-6) = 1,06 10-19 J = 0,66 eV soit la
différence d'énergie entre les niveaux n=4 et
n=3 )
- La valeur du produit ionique de l'eau augmente avec la température. exact. - A 37°C le pH=6,8 peut être considéré comme neutre. exact. ( pHneutre = -½log 2,5 10-14) - Dans une solution aqueuse d'hydroxyde de potassium telle que [HO-]= 2,5 10-3 mol/L, la concentration en ion oxonium vaut 1,1 10-11 mol/L à 37°C. faux. [H3O+]=
Ke / [HO-]= 2,5
10-14 / 2,5 10-3 = 1,0
10-11 mol/L. - Le quotient de réaction initial vaut zéro. faux. Qr, i = [ Fe2+]i/[Cd2+]i = 1. - La réaction évolue dans le sens direct. exact. ( Qr, i < K). - L'avancement final à
l'équilibre vaut à 1% près 1,11
10-3 mol.
faux. - Si on ajoute du cadmium solide au
mélange initial l'avancement final à
l'équilibre augmente.
faux.
L'expression de K ne contient pas le cadmium solide.
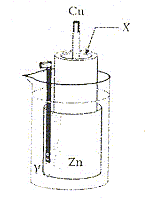
La réaction de fonctionnement est : Zn( s) + Cu2+(aq) = Cu( s) +
Zn2+(aq) avec K= 1037. Les deux solutions ont la même
concentration initiale. - Le métal constituant la borne positive est le cuivre. exact. - A l'état initial le quotient de réaction vaut 1037. faux. Qr, i = [ Zn2+]i/[Cu2+]i = 1. - Lorsque la pile est
complètement usée son quotient de
réaction est nulle.
faux.
Qr, éq = [
Zn2+]éq/[Cu2+]éq
= K.
n(e) = 1,08 109 / 96500 = 1,12 104 mol d'électrons. Or Cd2+(aq) + 2e- = Cd(s) d'où n( Cd ) =½ n(e) = 5,6 103 mol de cadmium m = nM = 5,6 103 * 112,4
= 6,29 105 g =
629 kg.
- L'ester obtenu est le butanoate d'éthyle. faux. étahnoate de butyle. (CH3-CO)2O + CH3-CH2-CH2-CH2OH --> CH3-COO-(CH2)3-CH3 + CH3COOH - Le volume de butan-1-ol utilisé est 91 mL. faux. m( alcool) = 74 g/mol ; n = 0,1 mol ; m = 7,4 g et V= m/r alcool =7,4/0,81 = 9,1 mL - La réaction est lente et limitée. faux. - Le rendement de cette réaction est 79%. faux. n(ester)
théorique = 0,1 mol ; M(ester) = 116 g/mol ;
m(ester) théorique =11,6 g ; rendement :
10,4/11,6*100 = 89%.
|
||||||||||||||||||||||||||||
|
|