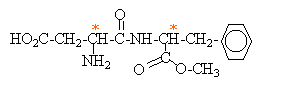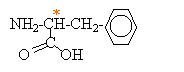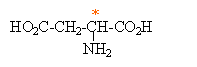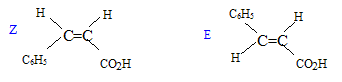|
Technicien de recherche ( Lille 1999) : aspartame ; chimie organique En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
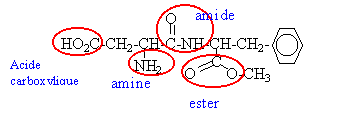
La molécule d'aspartame a pour formule semi-développée : 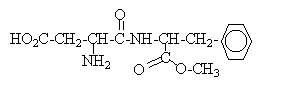
corrigé Les fonctions chimiques présentes dans ce composé :
Les atomes de carbone asymétriques. La molécule est chirale.
Produits obtenus par hydrolyse acide de l'aspartame après neutralisation du milieu : acide -3 phényl-2 aminopropanoïque
acide-2aminobutane-dioïque
l'hydrolyse de la fonction ester de l'aspartame conduit également au méthanol CH3OH, substance nocive pour l'organisme ; cette hydrolyse est accélérée en milieu acide.
|
|
|
L'analyse élémentaire donne pour un composé les pourcentages en masse suivants : C : 78,7% ; H : 8,2 % ; O : 13,1 %. La densité de vapeur de ce composé, par rapport à l'air est d = 4,2.
corrigé formule brute de ce composé A :CxHyOz. masse molaire M= 29 d = 29*4,2 = 122 g/mol 12 x/ 78,7 = 122/100 soit x = 8 y/8,2 = 122/100 soit y = 10 ; 16z/13,1 = 1,22 soit z = 1 C8H10O. A est un alcool primaire qui s'oxyde en acide carboxylique C6H5-CH2-COOH A est donc : C6H5-CH2-CH2OH : 2-phényléthan-1-ol ( pas de stéréoisomères) Stéréoisomères
de l'acide cinnamique : Par addition de dibrome dans un solvant, l'acide cinnamique donne un composé B : C6H5-CH=CH-COOH + Br2 = C6H5-CHBr-CHBr-COOH B : acide 2, 3-dibromo- 3-phénylpropanoïque Par action d'une base à chaud, le composé B perd une molécule d'acide bromhydrique et une molécule de CO2. On obtient C ( jasmin artificiel) : C6H5-CHBr-CHBr-COOH = HBr + CO2 + C6H5-CH=CHBr rendement de la synthèse : quantité de matière d'acide cinnamique C9H8O2 : M= 9*12+8+32=148 g/mol n = m/M= 20/148 = 1,35 10-1 mol D'après les coefficients stoechiométriques des équations de réaction, une mole d'acide cinnamique donne une mole de C masse molaire de C (C8H7Br ) : M= 8*12+7+80 = 183 g/mol masse théorique de C : m = nM=1,35 10-1 *183 = 24,7 g rendement : 100 * masse réelle / masse théorique = 100*10/24,7 =40 %. |
|
|
|
|
|
|
|
|