L'élément phosphore présents
dans les eaux de rejet urbaines a deux origines principales
: le métabolisme humain qui rejette le phosphore par
les urines et les rejets de détergents ( lessives aux
polyphosphates ). Rejeté dans les eaux de surface, il
entraîne un développement important des algues
ce qui implique la mise en oeuvre de normes strictes.
L'élément phosphore se retrouve dans les eaux
sous différentes formes : dans les
biomolécules ( phospholipides,
phosphoprotéines ) et dans les différentes
formes de l'acide phosphorique
H3PO4.
- Comment appelle t-on le phénomène de
prolifération des algues dans les eaux naturelles
?
eutrophisation.
- Ecrire les trois couples acide / base de l'acide
phosphorique.
réponse :
H3PO4 /
H2PO4- ;
H2PO4- /
HPO42- ;
HPO42- /
PO43-.
- Les pKa de ces trois couples sont
respectivement 1,9 ; 7,1 ; 12,3. Le pH des eaux de rejets
est compris entre 5 et 8. Justifier le fait que ces
dérivés soient principalement sous la forme
d'ions monohydrogénophosphate
HPO42-.
réponse : à pH
inférieur à pKa la forme acide
du couple acide / base prédomine.
couple : H3PO4 /
H2PO4- : pKa1
= 1,9 : H3PO4 prédomine
à pH<1,9.
couple H2PO4- /
HPO42-: pKa2 = 7,1 :
H2PO4- prédomine
à 1,9 < pH<7,1 ;
HPO42- prédomine à
7,1 < pH<12,3.
couple HPO42- /
PO43- : pKa3
= 12,3 : PO43- prédomine
à pH>12,3.
- On dispose d'une solution mère S0
de monohydrogénophosphate de sodium
présentant une teneur massique en
élément phosphore t0
= 2,0 mg/L. Quelle est la concentration molaire en ions
HPO42- de la solution
S0. Masse atomique molaire du phosphore : 31
g/mol.
réponse : 2Na+
aq+
HPO42-aq.
masse (g) / masse molaire du phosphore (g/mol) =2,0
10-3/ 31 = 6,5 10-5 mol
d'élément phosphore dans 1 L.
[HPO42-]
=6,5 10-5 mol /L.
- Ces ions traités par une solution acide de
molybdate de sodium donnent, après
réduction par l'acide ascorbique, une
espèce colorée présentant une forte
absorption à 700 nm. On se propose de
préparer une gamme d'étalonnage :
Dans une série de fioles jaugées de 50 mL
on a introduit les volumes V de S0 ainsi que
les réactifs comme indiqués dans le tableau
ci-dessous. Chaque fiole est complétée
à 50,0 mL avec de l'eau
distillée.
|
n° solution
|
blanc
|
S1
|
S2
|
S3
|
S4
|
S5
|
S6
|
|
V(mL)
|
0
|
1,0
|
2,0
|
4,0
|
6,0
|
8,0
|
10,0
|
|
sol. acide de molybdate
|
2 mL
|
|
sol. réductrice
|
1 mL
|
|
Absorbance A ( 700 nm)
|
0
|
0,025
|
0,047
|
0,102
|
0,148
|
0,197
|
0,246
|
Calculer la concentration massique en
élément phosphore da chacune des solutions
étalons.
réponse :
|
n° solution
|
blanc
|
S1
|
S2
|
S3
|
S4
|
S5
|
S6
|
|
V(mL)
|
0
|
1,0
|
2,0
|
4,0
|
6,0
|
8,0
|
10,0
|
|
facteur de dilution :F
|
xxxx
|
50/1 = 50
|
50/2 = 25
|
50/4 = 12,5
|
50/6 = 8,33
|
50/8 = 6,25
|
50/10 =5
|
|
concentration (mg/L) : c0/F =
2,0 / F
|
0
|
2/50 =0,04
|
2/25 =0,08
|
2/12,5 = 0,16
|
2/8,33 =0,24
|
2/6,25 =0,32
|
2/5 = 0,4
|
|
A ( 700 nm)
|
0
|
0,025
|
0,047
|
0,102
|
0,148
|
0,197
|
0,246
|
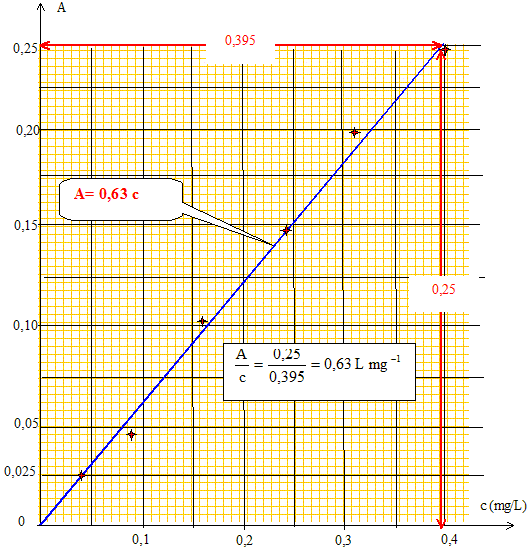
- A l'aide d'une méthode
graphique, établir la relation entre l'absorbance
A et la concentration massique c en
phosphore.
Traitement de l'eau de
rejet :
A un prélèvement de
47 mL on ajoute 2 mL et 1 mL des deux réactifs (
molybdate et réducteur) comme pour les
étalons. La mesure de l'absorbance donne
AERT= 0,264.
On réalise également
une mesure d'absorbance sur l'eau de rejet non
traitée ( 47 mL d'eau de rejet + 3 mL d'eau
distillée ) : on trouve AERN =
0,092.
- Justifier le calcul de la
concentration en phosphore des ions
monohydrogénophosphate à partir des
résultats de la question précédente en
utilisant comme absorbance la valeur AERT-
AERN .
- Déterminer la
concentration massique t
en élément phosphore du rejet
étudié ; des teneurs supérieures
à 0,5 mg/L laissent suspecter une pollution ; est-ce
le cas ?
réponse :
A=AERT- AERN
= 0,264-0,092 = 0,172
Le graphe donne : A= 0,63
t
soit t
= A/0,63 = 0,172/0,63 =
0,27
mg/L.
valeur inférieure à
0,5 mg/L : donc absence de pollution.
|
