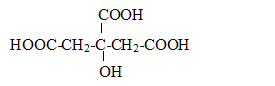|
Dosage de l'acide citrique dans la limonade concours assistant d'ingénieur 2007 chimiste En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||
| .
. |
|||||||||||||||||||||
|
|||||||||||||||||||||
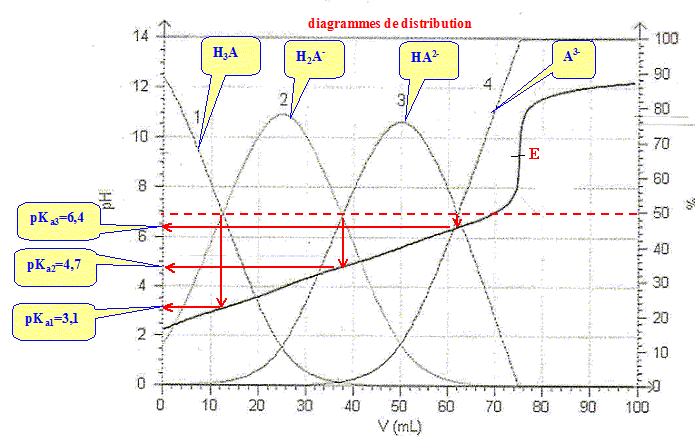
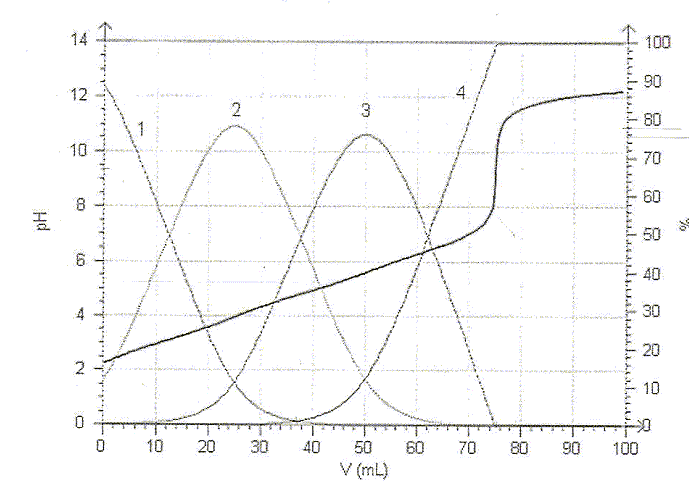
On observe un seul saut de pH car les pKa sont assez proches les uns des autres. la ( les) réaction(s) de dosage : H3A + HO- --> H2A- + H2O H2A- + HO- --> HA2- + H2O HA2- + HO- -->A3- + H2O Bilan : H3A + 3
HO- --> A3- +3
H2O. Lors du dosage des 50 mL de limonade par la soude décimolaire, on trouve un volume équivalent Ve= 12 mL. - Ecrire la condition réalisée à l'équivalence et en déduire la concentration de l'acide citrique dans la limonade. réponse : A l'équivalence, les quantités de matière des réactifs mis en présence sont en proportions stoechiomètriques. n(HO-) =3 n(H3A). 0,1 Ve = 3*50 [H3A] ; [H3A] = 0,1*12 /(3*50) = 8,0 10-3 mol/L.
On donne, pour les indicateurs colorés suivants, les zones de virage et les couleurs des formes acides et basiques.
Quel(s) est (sont), dans la liste ci-dessus, celui ( ceux) qui convient ( conviennent) pour le dosage précédent ? réponse : La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent ( proche de pH=9 dans ce cas ) La phénolphtaléine convient. Si la mesure du pH est destinée à connaître la valeur du pKa, quelle(s) précaution(s) doit-on prendre au préalable avant d'enregistrer la courbe ? réponse : Le pKa dépend de la température : repérer la température lors du dosage et travailler à température constante.
|
|||||||||||||||||||||
|
|
|||||||||||||||||||||
|
|