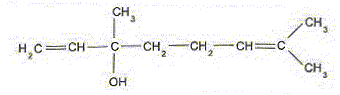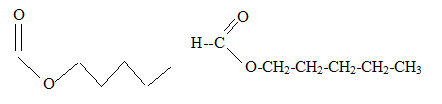|
concours Fesic estérification ; saponification ; savon. 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
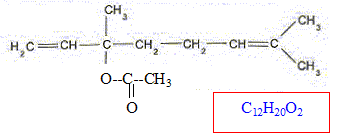
Par action de l'acide acétique sur le linalol, on peut synthétiser l''acétate de linalyle. Si les réactifs sont mélangés en proportions stoechiométriques de la réaction mise en jeu, le taux d'avancement final est de 5 %. A. La masse molaire de l'acétate de linalyle est 214 g/mol. Faux.
M= 12*12+20+32 = 196 g/mol. B. Le linalol présente une isomérie Z E. Faux.
C. Le linalol est un alcool tertiaire. Vrai. Le carbone porteur du groupe OH est relié à trois autres atomes de carbone. D. La constante d'équilibre de la réaction d'estérification vaut environ 2 10-5. Faux.
K = [ester]f [eau]f / ( [alcool]f [acide]f) = (0,05/0,95)2 = 2,8 10-3.
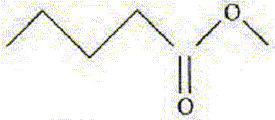
44*0,875 = 38,5. A. Le méthanoate de
pentyle a pour formule topologique
: Faux.
B. L'hydrolyse basique est une réaction totale. Vrai. C. Pour hydrolyser tout l'ester, le volume minimum de solution d'hydroxyde de potassium est 100 mL. Vrai. 0,5 mol d'hydroxyde de potassium est nécessaire volume (L) = quantité de matière (mol) / concentration (mol/L) =0,5/5 = 0,1 L = 100 mL. D. Le rendement est de 87,5 %. Vrai. Quantité théorique d'alcool, pentan-1-ol : n=0,5 mol masse molaire de l'alcool C5H12O : M= 5*12+12+16 = 88 g/mol masse théorique d'alcool m = nM= 0,5*84 = 44 g rendement : masse réelle / masse théorique *100 = 37,5 / 44*100 = 87,5 %.
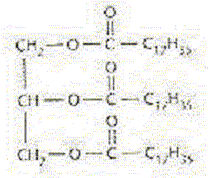
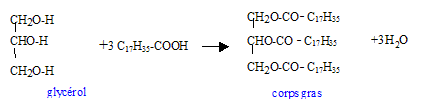
Il y a quelques décennies, les femmes lavaient le linge au lavoir en utilisant un mélange de suif ( graisse animale) et de cendres. les cendres de bois contenant de l'hydroxyde de potassium solide KOH(s) étaient recueillies dans un pot et mélangées à l'eau. La formule
semi-développée du suif est : pKa ( acide stéarique / ion stéarate ) = 5,0 ; pKa ( H3O+/H2O) = 0. A. Un élève annonce que pour synthétiser le suif au laboratoire il faut, en plus du glycérol, de l'acide stéarique C18H36O2. Vrai.
B. Il ajoute que, en mélangeant les cendres et le suif, le savon est inefficace en milieu acide. Faux. En mélangeant des cendres et du suif le milieu est basique. En milieu acide l'ion carboxylate RCOO- est sous forme RCOOH. L'ion carboxylate est responsable des propriétés détergentes. En milieu acide le savon est donc peu efficace. Pour reproduire le travail des ancêtres, on effectue une lessive : on mélange 25,0 L d'eau de dureté 20 degrés hydrotimétriques français et un mélange de suif et de cendres. Une eau est dure lorsqu'elle contient des ions calcium en grande quantité. Un degré hydrotimétrique français correspond à la présence de 0,100 mol d'ion Ca2+(aq) dans 1 m3 d'eau. C. Un élève prétend que la connaissance de la dureté de l'eau n'est pas utile pour l'expérience. Faux. Le carboxylate de calcium est insoluble. Les ions carboxylates, reponsables des propriétés détergentes, sont donc moins nombreux en solution. D. Un autre élève prétend qu'il faut plus de 32,2 g de savon pour effectuer la lessive prévue. Vrai. 25 L = 0,025 m3 ; Quantité de matière d'ion calcium présents dans 25 L d'eau : 0,1*0,025*20 = 0,05 mol Quantité de matière d'ion carboxylate sous forme de carboxylate de calcium solide : Ca2+(aq) + 2 R-COO-(aq) = Ca ( R-COO)2. n( RCOO-) = 2*0,05 = 0,1 mol. Masse molaire du savon : C18H35O2 K : M= 39 + 18*12+35+32 =322 g/mol masse minimale de savon : 322*0,1 = 32,2 g.
|
|||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||
|
|