|
Diplome d'accès aux études universitaires B pile cuivre argent, géraniol, acétate de géranyle. chimie 2005 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Dans un bécher, contenant une faible quantité de poudre d'argent et de cuivre métallique, on mélange 20 mL d'une solution de nitrate d'argent (Ag+aq, NO3-aq) de concentration 1,0.10-1 mol.L-1 avec 20 mL d'une solution de nitrate de cuivre (Cu2+aq, 2NO3-aq) de concentration 5,0.10-2 mol.L-1. Données : La constante d'équilibre associée à la réaction : 2 Ag+aq + Cu(s) = 2 Ag(s) + Cu2+aq vaut K = 2.1015 Masse molaire atomique du cuivre : 64 g/mol ; masse molaire atomique de l'argent : 108 g/mol On prendra: 1 faraday = 10 5 C.mol-1 Couleurs des solutions dues à la présence des ions : Ag+aq et NO3- aq : incolores ; Cu2+aq : bleue E°( Cu2+(Aq) ) / Cu(S) ) = 0,34 V et E°( Ag+(aq) / Ag(S) ) = 0,80 V.
Valeur initiale du quotient de réaction : 2 Ag+aq + Cu(s) = 2 Ag(s) + Cu2+aq Q r i = [Cu2+aq]i/[Ag+aq]i2 = 5 10-2 / 0,12 ; Q r i = 5. Q r i <K, donc évolution dans le sens direct. La solution initialement incolore,
prend progressivement une teinte bleue, présence de
l'ion Cu2+ (aq). Concentration en ions Ag+aq : K = [Cu2+aq]éq/[Ag+aq]éq2 = 2 1015. [Ag+aq]éq = {[Cu2+aq]éq/K}½ =(0,05/2 1015)½ ; [Ag+aq]éq = 5,0 10-9 mol/L Les ions argent ont pratiquement tous disparu : la pile ne fonctionne plus. On considère une pile
électrique constituée d'une solution de
nitrate d'argent (concentration 1,0.10-1
mol.L-1) et d'une solution de nitrate de cuivre
(concentration 5,0.10-2 mol.L-1)
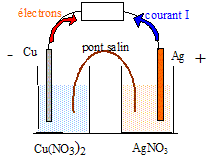
contenues dans des récipients reliés par un
pont salin et des lames de métaux appropriés
: Schéma de la pile.
Le cuivre est le réducteur le plus fort : il s'oxyde, libère des électrons et constitue la borne négative de la pile. Cu(s) = Cu2+(aq) + 2e-. Les ions argent, l'oxydant le plus fort, se réduisent : 2Ag+(aq) + 2e- = 2 Ag (s).
Tableau décrivant l'avancement de la réaction. = 2 10-3 = 0,01 = 10-3 = 0,01 Si Cu(s) est en défaut : 0,01-xmax=0 soit xmax=0,01 mol Retenir la plus petite valeur ; Ag+(aq) est le réactif limitant. Quantité d'électricité ayant traversé le conducteur ohmique lorsque la pile s'arrête de fonctionner : Ag+(aq) + e- = Ag (s) donc la quantité de matière d'électrons vaut : n(e-) =n(Ag+(aq))= 2 10-3 mol Q= n(e-) * F = 2 10-3*105 = 200 C.
Problème 2 : (6 points)
Le géraniol est un alcool primaire de formule brute C10H18O. On réalise la synthèse de l'acétate de géranyle à partir du géraniol et d'anhydride acétique (ou éthanoïque). On dispose d'une masse m1 de géraniol et d'un volume V d'anhydride acétique dont masse volumique est notée r . Données : m1 = 1,54 g ; V = 10,2 mL ; r = 1,08 g.cm-3 C : 12 ; H : 1,0 ; O : 16 g/mol. Géraniol : 154 g.mol-1, Acétate de géranyle : 196 g.mol-1; acide acétique : 60 g.mol-1
Equation de la réaction chimique utilisée : C10H18O + (CH3CO)2O ---> CH3COOH + CH3COO-C10H17. A l'anhydride acétique la réaction est
totale tandis qu'avec l'acide acétique elle est
limitée. M= 12*4+6+3*16 = 102 g/mol. Expression de la quantité de matière d'anhydride acétique en fonction de M, r et V : masse (g) = volume (mL) * masse volumique ( g/mL) m= Vr. quantité de matière (mol) = masse (g) / masse molaire (g/mol) n = m/M = Vr/ M ; n = 10,2*1,08/102 = 0,108 mol. Avancement maximal de la réaction :
Si l'anhydride acétique est en défaut : 0,108-xmax =0 soit xmax =0,108 mol Retenir la plus petite valeur. Masse d'acétate de géranyle théoriquement possible de préparer : m = n M( acétate de géranyle) = 0,01*196 = 1,96 g.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|