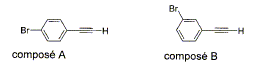|
Question
1 : ( 3 points )
Cocher la bonne réponse ( la bonne réponse est
écrite en rouge)
- La chromatographie d'exclusion
stérique est une technique de séparation :
de molécules volatiles ;
de
polymères ; de
molécules polaires.
- On se débarrasse de
petits morceaux de sodium non utilisés
après une expérience :
- En les jetant dans l'eau.
- En les enfermant dans une boîte hermétique
que l'on jette à la poubelle.
- En les jetant dans de
l'alcool.
- Le damine de longueurs d'onde
de la lumière visible est :
400 à 800 millimètres
; 400 à 800
nanomètres ; 400
à 800 cm-1.
- La température de
transition vitreuse (Tg) se rencontre habituellement dans
:
- les
polymères, les
sucres, les systèmes bicompatibles.
- Lors d'une extraction, on peut
ajouter du chlorure de sodium dans la phase aqueuse :
- Pour réduire la
solubilité du composé dans la phase
aqueuse
- Pour sécher le composé pendant
l'extraction.
- Pour rendre le composé totalement insoluble.
- La masse molaire de NaOH est
environ :
- 44 g/mol, 37 g/mol, 40
g/mol.
- La sublimation est une
technique de purification de :
-
Solide,
liquide, gaz.
- Le détendeur à
gaz fixé sur une bouteille d'azote peut aussi
être utilisé sur une bouteille :
-
d'oxygène,
d'hydrogène, d'argon.( azote et oxygène
ont de densités comparables)
- Pour une réaction qui
nécessite 100 ppm de catalyseur on utilisera :
- 1 10-4 mole
de catalyseur par mole de
réactif.
- 100 mg de catalyseur par mole de réactif.
- 1% de catalyseur par mole de réactif.
- 150 mL
est équivalent à :
- 1,5 mL ; 0,15
mL ; 0,15 cL.
- Le passage de -CH=CH- à
-CH2-CH2- est une réaction
:
- D'hydrogénolyse,
d'hydrogénation,
d'oxydoréduction.
- Le passage d'une fonction
aldehyde à une fonction acide est une
réaction :
-
D'oxydation,
de réduction, d'hydrolyse.
Question
2 : ( 1 point )
Indiquez par une croix les solvants
non miscibles à l'eau.
|
éthanol
|
dichlorométhane
|
tétrahydrofurane
|
cyclohexane
|
acétone
|
acétonitrile
|
|
x
|
|
x
|
|
|
Question 3
: ( 1,5 points )
Deux fournisseurs proposent
strictement le même composé, à un prix
différent. A partir de l'extrait de catalogue,
expliquer pourquoi on choisira le fournisseur A.
Fournisseur A : 100 mL ; 32,00 euros ; d=1,49
Fournisseur B : 100g ; 26,60 euros
; d= 1,49
Si la masse vaut m=100 g, le volume correspondant est : V=
100/1,49 = 67,1 mL
Fournisseur A : 0,32 euro
/mL ; fournisseur B : 26,6
/67,1 = 0,40 euro/mL.
Question 4
: ( 1,5 points )
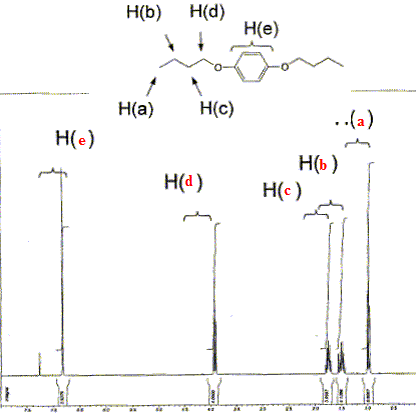
Le composé ci-dessous a
été caractérisé par RMN du
proton. Reporter sur le spectre les 5 types de protons
correspondant à cette molécule.
Question 5
: ( 2,5 points )
Rangez chacun des composés
dans l'endroit approprié ' un seul par
case)
Hydrure de lithium et d'aluminium ;
cyanure de potassium ; éther diéthylique ;
peroxyde de benzoyle ;
1,4-dibromobenzène.
|
produit
|
|
armoire de sécurité
fermée à clef avec accès
réservé
|
cyanure de
potassium
|
|
armoire à solvant
ventilée
|
éther
diéthylique
|
|
réfrigérateur
|
peroxyde de
benzoyle
|
|
dessicateur
|
Hydrure de lithium et
d'aluminium
|
|
placard général pour produits
chimiques sans conditions
particulières
|
1,4-dibromobenzène
|
Question 6
: ( 2,5 points )
Vous disposez d'une bouteille
d'acide chlorhydrique commerciale sur laquelle on peut lire
: HCl 37% en masse ; d=1,19 ; MM=36,46
g/mol
- Calculez la normalité de
cette solution commerciale.
- A partir de cette solution
comment préparer 1 L de solution 1N ?
Indiquez quelle est la procédure habituelle :
- On verse l'acide dans
l'eau ; on verse l'eau
dans l'acide.
Masse de 1 L de solution
commerciale : 1,19 kg ; masse d'acide pur : m=1,19*0,37 =
0,444 kg = 444 g
Quantité de matière
d'acide n = m/M=444/36,46
=12,1
mol dans 1L
Facteur de dilution = concentration
mère / concentration fille =F= 12,1 / 1 =
12,1
Volume de la pipette jaugée
(ou de la burette graduée) = volume de la fiole
jaugée / F = 1000/12,1 = 82,8 mL
Dans une fiole jaugée de 1 L
contenant de l'eau distilée, verser 82,8 mL de
solution commerciale; compléter avec de l'eau
distillée jusqu'au trait de jauge.
Agiter pour rendre
homogène.
Question 7
: ( 2 points )
Dessinez les formules
semi-développées planes :
- d'un alcool secondaire :
R-CHOH-R'
- du 1,4-dibromopentane :
BrCH2-CH2-CH2-CHBr-CH3.
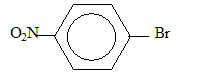
- du 1-bromo-4-nitrobenzène
- du N, Ndiméthylformamide(
DMF)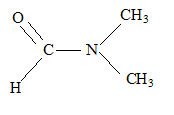
Question 9
: ( 2 points )
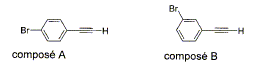
- Calculer la masse molaire et le
pourcentage massique de ces éléments (
composé A) C : 12 ; H : 1 ; Br : 80
g/mol.
- Parmi les techniques d'analyse,
cochez celles qui peuvent permettre de
différencier A et B.
- Analyse élémentaire ;
1H
RMN ;
mesure du point de
fusion ; mesure du
pouvoir rotatoire ; spectrométrie de
masse.
C8H5Br ;
M= 8*12+5+80 = 181 g/mol
% C : 8*12*100/181 =53,04 % ; % H :
5*100/181 =2,76 % ; % Br : 80 *100/181 =44,2 %
Question 10
: ( 2 points )

1 : substance toxique ; 2 :
substance comburante ; 3 : substance corrosive ; 4 :
dangereux pour l'environnement ; 5 :substance explosive ; 6
: substance comburante ; 7 : irritant ou nocif.
Partie
I : ( 20 points )
- Définir le terme "peser
environ exactement" 200 mg.
La masse à peser doit
être voisine de 200 mg, et on doit connaître
sa valeur avec
précision.
- Donner la définition du
pH
pH=-log
[H3O+]
avec [H3O+] exprimé
en mol/L.
- Quel est le pH d'une solution aqueuse d'HCL 0,1 M :
1.
- Expliquer la différence
entre ces deux isotopes : 136C et
126C
Le carbone 12 compte 6
neutrons et le carbone 13
compte 7
neutrons.
- Donner la formule
développée des fonctions suivantes :
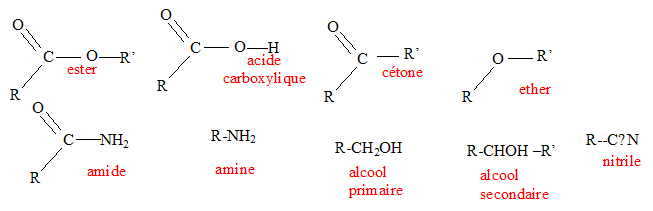
- Vous disposezr d'une solution
de départ à 50 10-3 M, vous
souhaitez obtenir 100 mL d'une solution à 5
10-3 M. Quelle quantité de solution de
départ prélevez-vous ?
Facteur de dilution F= 10 ; le volume de la pipette
jaugée est donc 10 fois plus petit que celui de la
fiole jaugée ( 10
mL)
- Quells sont les
éléments de protection individuelle
indispensables lors d'expérience au laboratoire de
chimie ?
Blouse, gants et lunettes.
- Un de vos collègue reçoit dans les yeux
une projection de soude. Quelle démarche
prioritaire adoptez-vous ?
- Vous téléphonez au SAMU.
- Vous lui lavez les yeux avec une solution d'acide
diluée.
- Vous lui lavez les yeux
avec de l'eau.
- Donner le domaine spectral du
visible. 400 à 800
nm.
- Une température de
35°C équivaut à combien en Kelvin ?
273+35 =308
K.
- Equilibrer la demi
équation d'oxydoréduction faisant
intervenir le couple
MnO4-/Mn2+.
MnO4-+
8H+ + 5e- =
Mn2++4H2O
- Toutes vos données
expérimentales sont à intégrer dans
un document sous forme de tableur. Vous souhaitz ainsi
présenter vos résultats sous forme de
diagramme, quel logiciel pourriez-vous utiliser ?
Exel.
- Donnez la définition
d'un carbone asymétrique
Carbone tétragonal
possédant 4 substituants
différents.
- Qu'appelle t-on composés
énantiomères ?
Molécules images
l'une de l'autre dans un
miroir.
- Trouver en justifiant les molécules chirales
parmi celles proposées ci-dessous.
B et C sont chirales ; elles possèdent un atome de
carbone asymétrique repéré par
*.
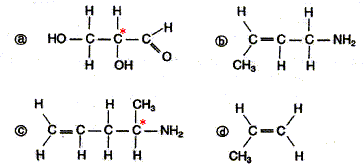
Représentation des
énantiomères :
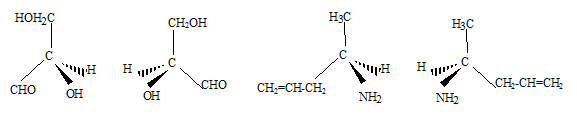
Partie II
: ( 20 points )
- Faire un schéma simplifié d'un
appareillage de chromatographie liquide haute performance
en indiquant le nom de chaque composant actif et leur
rôle respectif.
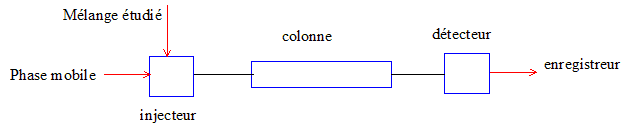
La colonne ( tube construit avec un matériau
inerte aux produits chimiques) contient la phase
stationnaire :
- phase normale : gel de silice polaire ; on
utilise un éluant apolaire ; les produits polaires
sont retenus dans la colonne, les produits apolaires
sortent en premiers.
- phase inverse : phase fixe apolaire ;
éluant polaire ; les molécules polaires
sortent en premier.
Détecteur UV-visible ; réfractomètre
( mesure de l'indice de réfraction du liquide
à la sortie)
- Classer les solvants suivants par ordre de
polarité décroissante : heptane, eau,
éthanol, méthanol, isopropanol.
eau, méthanol,
éthanol, isopropanol, heptane.
- Citer trois types de phase stationnaire
utilisées en chromatographie liquide haute
performance.
- oxyde d'aluminium, les silicates
de magnésium, les gels de silice.
- En chromatographie liquide haute performance, le
volume d'échantillon injecté est de l'ordre
de : 20 ml, 5 mL, 10
mL,
20 nL.
- Le diamètre des particules de la phase
stationnaire qui remplissent une colonne en
chromatographie liquide haute performance est de l'ordre
de :
5 mm,
5 mm, 0,5
m m, 500 m
m.
On se propose de séparer par
chromatographie liquide haute performance 2 composés
A et B.
Conditions opératoires : phase stationnaire
polaire ; débit de la phase mobile : 1,7 mL/min ;
détection à une longueur d'onde de 260 nm pour
les deux composés.
Données : temps de
rétention : composé A 2,24 min ;
composé B 5,17 min.
- Quel est dans ces conditions le
composé le plus polaire ? Le composé
le plus polaire
B, sort le dernier car
la phase stationnaire est polaire.
- La phase mobile est-elle polaire ou non polaire ?
non
polaire.
- Quel est le type de détecteur utilisé et
dans quel domaine de longueur d'onde travaille t-on ?
Détecteur
UV. ( mesure de
l'absorbance)
- Rappeler l'équation de Beer Lambert en
précisant les unités utilisées.
La loi de
Berr-Lambert exprime la variation de
l'intensité lumineuse en fonction de la distance
parcourue dans un milieu transparent.
Lorsqu'une lumière monochromatique
d'intensité I0 traverse un milieu
homogène, l'intensité de la lumière
émergente I décroît exponentiellement
lorsque l'épaisseur l du milieu absorbant augmente.
I = I0 . e (-
al)
a est une constante appelée coefficient
d'absorption, caractéristique du milieu et de la
longueur d'onde considérés.
Dans le cas des solutions, la loi de Beer fait intervenir
les concentrations.
I = I0 . e (-
elc)
où e
est un coefficient caractéristique de la
substance appelé coefficient d'absorbance
(L mol-1
cm-1),
l est
l'épaisseur de la cuve
(cm) et
c la concentration de la solution
(mol/L).
Cette loi est vérifiée lorsque la solution
est de concentration inférieure à : c < 0,1
mol.L-1.
La relation fondamentale utilisée en
spectrophotométrie est présentée sous
la forme :
A= log (I0/I) =
elc
( A est
l'absorbance
ou densité
optique)
e
est une caractéristique de la
molécule. Plus e
sera grand, plus la solution absorbe.
- - Comment varient les temps de
rétention des composés A et B si le
débit de la phase mobile est fixé à
1 mL/min
Les
temps de rétention
augmentent si le débit
diminue.
Avantages et
inconvénients d'un réfractomètre
:
Avantages :
- détecteur universel ( il n'est utilisable si la
substance à analyser possède un indice de
réfraction identique à celui de la phase
mobile.
- facteur de réponse
identique pour produits de la même classe.
Inconvénients :
- manque de
sensibilité
- très sensible à la
température qui doit être
contrôlée et à la variation de
débit.
|