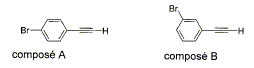|
Question
1 : ( 3 points )
Cocher la bonne réponse ( la bonne réponse est
écrite en rouge)
- La chromatographie d'exclusion
stérique est une technique de séparation :
de molécules volatiles ;
de
polymères ; de
molécules polaires.
- On se débarrasse de
petits morceaux de sodium non utilisés
après une expérience :
- En les jetant dans l'eau.
- En les enfermant dans une boîte hermétique
que l'on jette à la poubelle.
- En les jetant dans de
l'alcool.
- Le damine de longueurs d'onde
de la lumière visible est :
400 à 800 millimètres
; 400 à 800
nanomètres ; 400
à 800 cm-1.
- La température de
transition vitreuse (Tg) se rencontre habituellement dans
:
- les
polymères, les
sucres, les systèmes bicompatibles.
- Lors d'une extraction, on peut
ajouter du chlorure de sodium dans la phase aqueuse :
- Pour réduire la
solubilité du composé dans la phase
aqueuse
- Pour sécher le composé pendant
l'extraction.
- Pour rendre le composé totalement insoluble.
- La masse molaire de NaOH est
environ :
- 44 g/mol, 37 g/mol, 40
g/mol.
- La sublimation est une
technique de purification de :
-
Solide,
liquide, gaz.
- Le détendeur à
gaz fixé sur une bouteille d'azote peut aussi
être utilisé sur une bouteille :
-
d'oxygène,
d'hydrogène, d'argon.( azote et oxygène
ont de densités comparables)
- Pour une réaction qui
nécessite 100 ppm de catalyseur on utilisera :
- 1 10-4 mole
de catalyseur par mole de
réactif.
- 100 mg de catalyseur par mole de réactif.
- 1% de catalyseur par mole de réactif.
- 150 mL
est équivalent à :
- 1,5 mL ; 0,15
mL ; 0,15 cL.
- Le passage de -CH=CH- à
-CH2-CH2- est une réaction
:
- D'hydrogénolyse,
d'hydrogénation,
d'oxydoréduction.
- Le passage d'une fonction
aldehyde à une fonction acide est une
réaction :
-
D'oxydation,
de réduction, d'hydrolyse.
Question
2 : ( 1 point )
Indiquez par une croix les solvants
non miscibles à l'eau.
|
éthanol
|
dichlorométhane
|
tétrahydrofurane
|
cyclohexane
|
acétone
|
acétonitrile
|
|
x
|
|
x
|
|
|
Question 3
: ( 1,5 points )
Deux fournisseurs proposent
strictement le même composé, à un prix
différent. A partir de l'extrait de catalogue,
expliquer pourquoi on choisira le fournisseur A.
Fournisseur A : 100 mL ; 32,00 euros ; d=1,49
Fournisseur B : 100g ; 26,60 euros
; d= 1,49
Si la masse vaut m=100 g, le volume correspondant est : V=
100/1,49 = 67,1 mL
Fournisseur A : 0,32 euro
/mL ; fournisseur B : 26,6
/67,1 = 0,40 euro/mL.
Question 4
: ( 1,5 points )
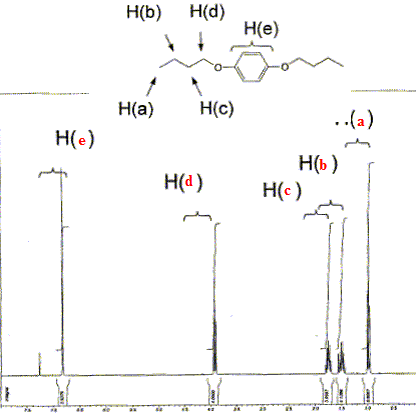
Le composé ci-dessous a
été caractérisé par RMN du
proton. Reporter sur le spectre les 5 types de protons
correspondant à cette molécule.
Question 5
: ( 2,5 points )
Rangez chacun des composés
dans l'endroit approprié ' un seul par
case)
Hydrure de lithium et d'aluminium ;
cyanure de potassium ; éther diéthylique ;
peroxyde de benzoyle ;
1,4-dibromobenzène.
|
produit
|
|
armoire de sécurité
fermée à clef avec accès
réservé
|
cyanure de
potassium
|
|
armoire à solvant
ventilée
|
éther
diéthylique
|
|
réfrigérateur
|
peroxyde de
benzoyle
|
|
dessicateur
|
Hydrure de lithium et
d'aluminium
|
|
placard général pour produits
chimiques sans conditions
particulières
|
1,4-dibromobenzène
|
Question 6
: ( 2,5 points )
Vous disposez d'une bouteille
d'acide chlorhydrique commerciale sur laquelle on peut lire
: HCl 37% en masse ; d=1,19 ; MM=36,46
g/mol
- Calculez la normalité de
cette solution commerciale.
- A partir de cette solution
comment préparer 1 L de solution 1N ?
Indiquez quelle est la procédure habituelle :
- On verse l'acide dans
l'eau ; on verse l'eau
dans l'acide.
Masse de 1 L de solution
commerciale : 1,19 kg ; masse d'acide pur : m=1,19*0,37 =
0,444 kg = 444 g
Quantité de matière
d'acide n = m/M=444/36,46
=12,1
mol dans 1L
Facteur de dilution = concentration
mère / concentration fille =F= 12,1 / 1 =
12,1
Volume de la pipette jaugée
(ou de la burette graduée) = volume de la fiole
jaugée / F = 1000/12,1 = 82,8 mL
Dans une fiole jaugée de 1 L
contenant de l'eau distilée, verser 82,8 mL de
solution commerciale; compléter avec de l'eau
distillée jusqu'au trait de jauge.
Agiter pour rendre
homogène.
Question 7
: ( 2 points )
Dessinez les formules
semi-développées planes :
- d'un alcool secondaire :
R-CHOH-R'
- du 1,4-dibromopentane :
BrCH2-CH2-CH2-CHBr-CH3.
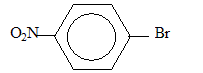
- du 1-bromo-4-nitrobenzène
- du N, Ndiméthylformamide(
DMF)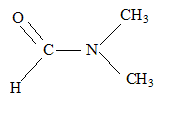
Question 9
: ( 2 points )
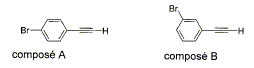
- Calculer la masse molaire et le
pourcentage massique de ces éléments (
composé A) C : 12 ; H : 1 ; Br : 80
g/mol.
- Parmi les techniques d'analyse,
cochez celles qui peuvent permettre de
différencier A et B.
- Analyse élémentaire ;
1H
RMN ;
mesure du point de
fusion ; mesure du
pouvoir rotatoire ; spectrométrie de
masse.
C8H5Br ;
M= 8*12+5+80 = 181 g/mol
% C : 8*12*100/181 =53,04 % ; % H :
5*100/181 =2,76 % ; % Br : 80 *100/181 =44,2 %
Question 10
: ( 2 points )

1 : substance toxique ; 2 :
substance comburante ; 3 : substance corrosive ; 4 :
dangereux pour l'environnement ; 5 :substance explosive ; 6
: substance comburante ; 7 : irritant ou nocif.
|