|
Aide laboratoire ( d'après concours groupe Est 2006) électricité, solution de soude, sécurité. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
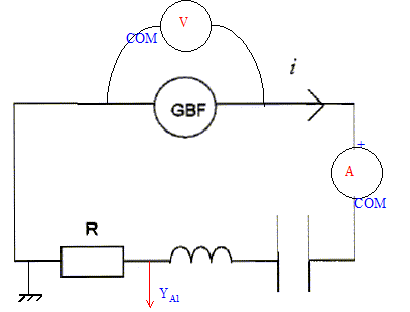
Un professeur vous demande de sortir le matériel nécessaire pour réaliser le montage suivant : 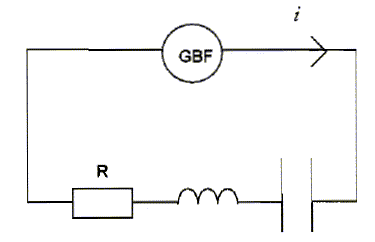
Le générateur doit être réglé sur la tension 12 V
corrigé 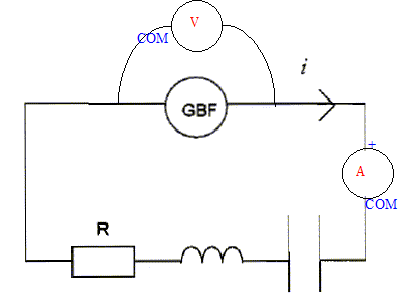
la liste du matériel : GBF, résistor, condensateur, bobine inductive, voltmètre, ampèremètre, fils. La zone VAC doit être choisie, le GBF délivre un signal variable, périodique. Le calibre 20 V doit être choisi, valeur supérieure à 12 V et la plus proche. On s'aperçoit que l'ampèremètre ne fonctionne pas. On souhaite s'assurer par une mesure que son fusible n'est pas grillé. On branche le fusible sur un ohmètre. Si le fusible n'est pas détérioré, l'ohmètre indique une valeur très faible, quelques dixièmes d'ohm ; si le fusible est détérioré, le voltmètre indique une valeur très grande ( infinie). On veut visualiser l'image de l'intensité du courant électrique qui circule dans le circuit RLC à laide d'un oscilloscope. La tension aux bornes d'un résistor et l'intensité qui le traverse sont proportionnelles. Visualiser la tension aux bornes du conducteur ohmique, c'est obtenir l'image de l'intensité.
|
|
|
On prend g = 10 N/kg. La relation entre poids et masse peut s'écrire P=mg.
corrigé masse = 0,2 kg ; poids P=0,2*10 = 2 newton (N) Une balance mesure une masse ; un dynamomètre mesure un poids ou une force.
|
|
|
On dispose de paillettes de soude ( hydroxyde de sodium). On souhaite préparer 100 mL d'une solution d'hydroxyde de sodium de concentration massique 60 g/L.
corrigé masse de solide : 100 mL= 0,1 L; donc 6 g dans 0,1 L le matériel à utiliser : balance, spatule, sabot de pesée. becher de 100 ml + agitateur en verre + pissette d'eau distilée pour dissoudre le solide. fiole jaugée de 100 mL + bouchon+ entonnoir le produit est corrosif donc port de blouse, gants et lunettes. concentration molaire de cette solution : quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 6/40 = 0,15 mol concentration molaire (mol/L) = quantité de matière (mol) / volume de la solution (L) = 0,15 / 0,1 = 1,5 mol/L. l'étiquette indique " hydroxyde de sodium " ; C= 1,5 mol/L ; pictogramme n°2 , produit corrosif. La solution "souillée" est placée dans le fût de récupération des bases.
|
|
corrigé Le mélange d'une solution d'acide avec de l'eau de javel peut conduire à un dégagement de dichlore, gaz toxique. Pour diluer une solution concentrée d'acide sulfurique, on verse l'acide dans l'eau ( on évite les projections d'acide concentré). Le sodium solide doit être conservé dans l'huile. ( réaction violente du sodium avec l'eau ; un peu moins violente avec l'alcool)
|
|
|
|