|
Concours Capes interne : le phosphore en chimie organique ; synthèse de l'acétanilide 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||
|
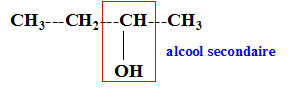
I. Utilisation du tribromure de phosphore : Le butan-2-ol réagit avec le tribromure de phosphore pour donner un composé A et de l'acide phosphoreux H3PO3. Le solvant utilisé a pour formule (CH3CH2)2O.
Pour améliorer le rendement, on remplace l'acide acétique par un dérivé d'acide ( chlorure d'acyle ou anhydride d'acide).
I. Utilisation du tribromure de phosphore : Le butan-2-ol réagit avec le tribromure de phosphore pour donner un composé A et de l'acide phosphoreux H3PO3. Le solvant utilisé a pour formule (CH3CH2)2O. Formule semi-développée du butan-2-ol:
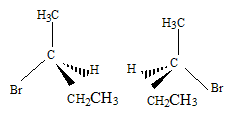
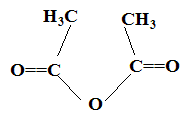
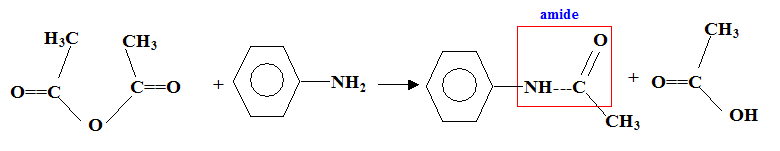
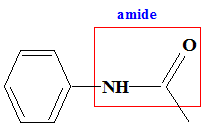
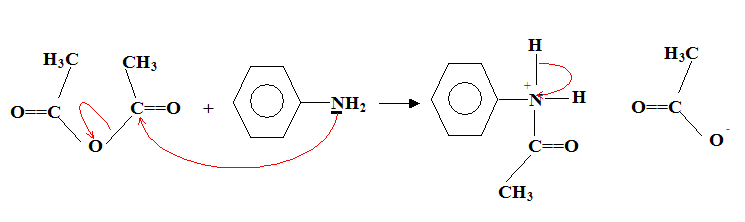
Nom du solvant utilisé : éther éthylique ou diéthyloxyde , ou éthoxyéthane. Nom de de A : 2-bromobutane Représentation de Cram des différents stéréoisomères de A : II. Synthèse d'un fébrifuge : l'acétanilide : Le pentachlorure de phosphore réagit avec l'acide éthanoïque pour donner le chlorure d'éthanoyle, de l'oxychlorure de phosphore POCl3 et du chlorure d'hydrogène. PCl5 + CH3COOH = POCl3 + CH3COCl + HCl. Mécanisme
réactionnel :
"site nucléophile" :( ami des noyaux positifs) site riche en électrons. Position de ces sites sur les réactifs :
Rôle de la pierre
ponce : régularise l'ébullition lors du
chauffage à reflux.
Rendement de la synthèse : Quantités de matière initiales : masse(g) = volume (mL) * masse volumique (g/mL) m( aniline) = 10*1,02 = 10,2 g ; masse (anhydride) = 15*1,08 =16,2 g quantité de matière (mol) = masse (g) / masse molaire (g/mol) n(aniline) = 10,2/93 = 0,1097 mol
(0,110) ; n( anhydride) = 16,2/102 =0,1588
mol(0,159) si (CH3CO)2O en défaut : 0,1590-xmax =0 ; xmax =0,159 ( on retient la plus petite valeur) Le réactif limitant est C6H5-NH2 On a ajouté les 10 mL d'eau
distillée sans attendre le refroidissement du milieu
réactionnel afin de transformer l'excès
d'anhydride éthanoïque en acide
éthanoïque. masse (acéthanilide) = 0,110 * 135 = 14,8 g rendement = masse expérimentale / masse théorique *100 =11,6/14,8*100 = 78,4 %. |
||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|