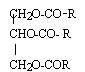|
Bts esthétique 2001 : acide lactique, triglycérides, électricité En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||
| .
. |
|||
|
|||
L'huile de ricin est un corps gras utilisé en cosmétologie. Elle est constituée essentiellement de triricinoléate de glycéryle, de masse molaire M= 932 g/mol, molécule insaturée désignée par A.
corrigé Masse molaire acide lactique C3H6O3 : M =3*12+6+3*16 =90 g/mol. Quantité de matière (mol) = masse (g) / masse molaire (g/mol) : n = m/M = 18/90 =2,0 10-1 mol. concentration (mol/L) = quantité de matière (mol) / volume de la solution (L) = n/V = 0,2 / 0,25 =8,0 10-1 mol/L. Equation bilan de la réaction de l'acide lactique avec l'eau : CH3-CHOH-COOH + H2O = CH3-CHOH-COO- + H3O+. constante d'équilibre ou constante d'acidité du couple acide base CH3-CHOH-COOH /CH3-CHOH-COO- Ka =[ H3O+][CH3-CHOH-COO-] / [CH3-CHOH-COOH] ; pKa = - log Ka c : concentration de l'acide lactique ; pH = - log [ H3O+] avec [ H3O+] exprimée en mol/L Conditions de validité de la relation pH= ½( pKa + log c) : solution pas trop concentrée afin de confondre activité et concentration ; l'acide doit être peu dissocié afin que CH3-CHOH-COO- soit négligeable devant [CH3-CHOH-COOH] pH = 0,5(3,9 + log 8 10-1) =1,9. d'où [ H3O+]=[CH3-CHOH-COO-]= 10-1,9=1,25 10-2 mol/L et [CH3-CHOH-COOH] = 0,8-0,0125 =0,787 mol/L La relation pH= ½(
pKa + log c) était donc bien appliquable.
Une solution tampon permet de maintenir le pH constant par suite d'une dilution modérée. Pour obtenir une lotion de pH égal à 3,9 à partir d'une solution d'acide lactique de concentration 0,01 mol/L, il faut ajouter de la soude jusqu'à ce que : [CH3-CHOH-COO-]
=[CH3-CHOH-COOH] =0,01/2 = 0,005 mol/L
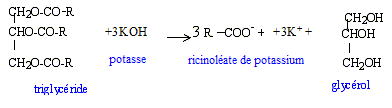
Equation bilan de la saponification d'un triglycéride avec une solution d'hydroxyde de potassium :
Masse d'hydroxyde de potassium nécessaire à l'obtention de 10 g de ricinoléate de potassium : La masse molaire du triglycéride est égale à : 3 masse molaire de R + ( 6*12+5+6*16) M = 3MR + 173 = 932 doù MR= (932-173) / 3 = 253 g/mol M (RCOOK) = 253+12+32+39=336 g/mol n(RCOOK) = m/M = 10/336 = 2,98 10-2 mol d'après les coefficients de l'équation ci-dessus : n( potasse) = n(RCOOK) m(potasse) = 2,98 10-2
*(39+16+1) =1,67 g.
L'hydrogénation catalytique de A donne une chaîne carbonée saturée. Le produit, corps gras saturé, est un solide. L'indice d'iode d'un corps gras A est la masse de diiode (I2), exprimée en grammes, que peut fixer 100 g de A. Relation entre les quantités de matière de diiode et A : n( triglycéride) = 100 / 932 = 0,107 mol. n(I2) = 82/(2*127) = 0,323 mol d'où n(I2) = 3 n( triglycéride). La molécule A compte 3 liaisons doubles C=C.
Un broyeur porte les indications suivantes : 220 V ; 550 W. Cet appareil est constitué d'un moteur qui permet la rotation d'un couteau. La résistance interne du moteur vaut r =2W. Le moteur est conçu pour un fonctionnement assez bref : au delà de 7 min d'utilisation il convient de laisser le broyeur se refroidir pendant 10 min. Un interrupteur de protection contre les surintensités est intégré au circuit électrique de l'appareil. On admettra que les lois du courant continu s'appliquent.
corrigé Intensité du courant : P= UI soit I= P/U = 550/220 = 2,5 A. Force contre électromotrice du moteur : U = E+rI soit E=U-rI = 220-2*2,5 = 215 V. Puissance dissipée par effet Joule dans le bobinage du moteur : PJ= rI2 = 2*2,52 = 12,5 W Quantité de chaleur dissipée dans le bobinage au bout de 7 min de fonctionnement : Q= PJDt
= 12,5*7*60 = 5,25 kJ.
Puissance dissipée par effet Joule dans le moteur : rI2 = 2*110*110 = 24 kW. L interrupteur de protection contre les surintensités, intégré au circuit électrique de l'appareil coupe l'alimentation du moteur ; sinion le moteur serait grillé. |
|||
|
Un appareil à cire est constitué d'une cuve en aluminium de masse 0,25 kg chauffé par une résistance thermo-régulée.La puissance électrique de cet appareil est 200 W. La cuve contient 500 g de cire, ressolidifiée après fusion et épousant la forme de la cuve. L'ensemble est à la température ambiante de 18°C. Cette cire dite "tiède" commence à fondre à 37°C. Le début de la fusion est observé au bout de 2 min 10 s.
corrigé Capacité thermique massique, notée c, de la cire solide : énergie électrique reçue en Dt =2 min 10 s = 130 s : Q1= P Dt =200*130 = 2,6 104 J énergie reçue par la cire : Q= m c Dq =0,5 c* (37-18) = 9,5 c énergie reçue par l'aluminium : Q' = m Al cAl Dq = 0,25*895*(37-18) =4,25 103 J Q1 = Q+Q' ; 2,6 104 = 9,5 c + 4,25 103 ; c = ( 2,6 104-4,25 103)/ 9,5 = 2289 J kg-1 K-1. Cette cire n'étant pas un corps pur, sa température de fusion n'est pas constante. Quantité de chaleur nécessaire à cette seconde étape : P Dt = 200*12*60 = 1,44 105 J Quantité de chaleur nécessaire à la fusion de 1 kg de cette cire : 2*1,44 105 = 2,88 105 J kg-1.
|
|||
|
|