|
stockage des eaux de ruissellement BTS EEC 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||
| .
. |
|||||
|
|||||
|
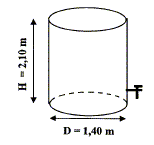
Diamètre D=1,40 m ; hauteur H=2,10 m. Le taux de remplissage est de 80%.
Données : masse volumique de l'eau r= 1000 kg m-3 ; constante d'autoprotolyse de l'eau Ke = [H3O+][HO-]= 10-14. Traitement de l'eau. L'eau recueillie est acide. Elle contient, en plus ou moins grande quantité des sulfates, du sodium, du calcium, de l'ammonium, et même des nitrates, en fonction des sols traversés. Nommer chacun des ions suivants : ion Ca2+ ; ion NO3-. ion calcium et ion nitrate
Cette eau est-elle acide ou basique ? Justifier. Lorsque le pH est inférieur à 7, la solution aqueuse est acide. Calculer la concentration molaire en ion H3O+. [H3O+] = 10-pH =
10-4,6 = 2,5
10-5 mol/L.
Quel doit être la valeur du pH de l'eau après neutralisation ? La solution aqueuse est neutre : le pH est égal à 7.
H3O+
+ HO- = 2H2O. volume de la cuve cylindrique remplie à 80% : V= pD H*0,80 = 3,14*1,4*2,1 *0,80 = 7,389 m3 = 7389 L. quantité de matière (mol) d'ion H3O+ = concentration (mol/L) * volume (L) n = 2,5 10-5 *7389 =0,185 mol La quantité de matière de soude ajoutée est égale à la quantité de matière d'ion H3O+. volume (L) = quantité de matière (mol) / concentration (mol/L) = 0,185 / 0,1 = 1,8 L.
Protection contre la corrosion : Données : Potentiel standard d'oxydoréduction Zn2+ + 2e- = Zn E°= -0,77 V Fe2+ + 2e- = Fe E°= -0,44 V Quantité d'électricité transportée par une mole d'électrons : F=96500 C mol-1. Masse atomique du zinc M=65,4 g/mol Afin de protéger la cuve en acier, on pulvérise une fine couche de zinc sur toutes ses faces. A l'aide des données montrer que le zinc peut assurer la protection de la cuve. Le zinc ( E°= -0,77 V) est un métal plus réducteur que le fer ( E°= -0,44 V ) : il va donc s'oxyder à la place du fer. Le fer est protégé
tant qu'il y a du zinc.
En déduire le nombre de moles d'électrons transférés. n(e-) =Q/F = 1,89 106 /96500 =19,6 mol. Calculer la masse de zinc consommée en deux ans. D'après Zn2+ + 2e- = Zn, la quantité de matière (mol) de zinc est égale à la moitié de la quantité de matière d'électrons. n(Zn) =½ n(e-) =19,6/2 = 9,8 mol masse (g) = masse molaire (g/mol) * quantité de matière (mol) m = 65,4*9,8 = 640g = 0,64 kg.
|
|||||
|
|
|||||
|
|