|
Le sulfure d'hydrogène : un acide, un réducteur BTS métiers de l'eau 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||
| .
. |
|||||
|
|||||
|
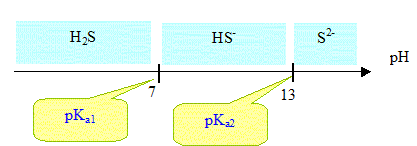
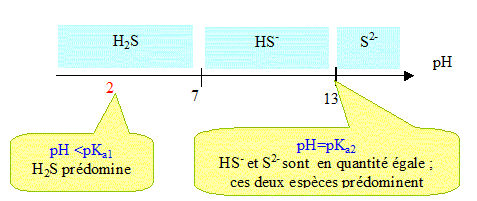
Données : 11H ; 3216S ; 5525Mn. Produits de solubilité ( à 25 °C) NiS : Ks1 = 10-21 ; MnS : Ks2 = 10-16. Constante d'acidité : couple H2S/HS- : Ka1 = 10-7 ; couple HS-/S2- Ka2 = 10-13. La molécule de sulfure d'hydrogène : Donner la structure électronique des atomes suivants : hydrogène H, soufre S, manganèse Mn. H : 1 s1 ; S : 1s2 2s2 2p6 3s2 3p4 ; Mn : 1s2 2s2 2p6 3s2 3p6 4s2 3d5 Justifier la formule de l'ion S2-. L'atome de soufre a tendance à compléter à huit sa couche électronique externe ( règle de l'octet ). Pour cela il gagne facilement deux électrons et donne l'ion S2-. Le sulfure d'hydrogène est un diacide : Définir un acide au sens de Brönsted. Espéce, ion ou molécule, susceptible de céder un proton H+. Ecrire les équations des réactions avec l'eau qui se produisent lors de la dissolution de H2S. couples acide / base : H2S/HS- ; H3O+/H2O H2S + H2O = HS- + H3O+ (1) couples acide / base : HS-/S2- ; H3O+/H2O HS- +H2O = S2- + H3O+(2) (1)
Ka1 = [HS-][H3O+]
/ [H2S] (2)
Ka2 = [S2-][H3O+]
/ [HS-] Tracer sur un axe
horizontal de pH, le diagramme de
prédominance des
espèces. Indiquer la ou les espèce(s) prédominante(s) à pH=2 et à pH=13.
On considère une solution aqueuse de sulfure d'hydrogène de concentration C=5,0 10-2 mol/L. On considèrera que, dans ces conditions, le couple HS-/S2- n'a pas d'influence sur la valeur du pH. Etablir l'expression littérale du pH de la solution. (1) Ka1 = [HS-][H3O+] / [H2S] Conservation de l'élément soufre : [HS-] +[H2S] = C (3) La solution reste électriquement neutre ( en milieu acide HO- est négligeable) : [ HS-]=[H3O+] (4) repport dans (1) : Ka1 = [H3O+]2 / [H2S] (5) (3) donne : [H2S] = C-[HS-] = C-[H3O+] repport dans (5) : Ka1 = [H3O+]2 / (C-[H3O+] ) Dans l'hypothèse où C >> [H3O+] il vient : Ka1 = [H3O+]2 / C [H3O+] = (Ka1C )½. log[H3O+] = ½[logKa1+log C] pH= - log[H3O+] = ½[pKa1-log C]. Calculer la valeur du pH. pH= ½(7-log(0,05)]= 4,2. [H3O+] = 10-4,2 = 7 10-5 mol/L, valeur très inférieure à C=0,05 ( hypothèse confirmée).
Le sulfure d'hydrogène est un réducteur : obtention de soufre. Définir un réducteur . Espèce, ion ou molécule, susceptible de libérer un ou plusieurs électrons dans un réaction appelée "oxydation". Indiquer le nombre d'oxydation (n.o) de l'élément soufre dans H2S(g) et dans S(s). Le nombre d'oxydation de l'élément hydrogène est +1 ; dans H2S, la somme des nombre d'oxydation de tous les éléments est nulle, doù : n.o(S) + 2 n.o(H) = 0 ; n.o(S) +2 = 0 ; n.o(S) = -2. Dans un corps pur simple, S(s) le nombre d'oxydation de l'élément est nul : n.o(S) =0 dans S(s). Ecrire la demi-équation électronique du couple S(s) / H2S(aq) en solution aqueuse). H2S(aq)=S(s) + 2H+(aq) + 2e- (1) Ecrire la demi-équation électronique du couple SO2(aq) / S(s) en solution aqueuse). SO2(aq) +4H+(aq) + 4e- = S(s) + 2H2O(l) (2) Ecrire la demi-équation électronique du couple SO2(aq) / H2S(aq) en solution aqueuse). Faire 2 fois (1) + (2) : 2H2S(aq) +
SO2(aq) = 3S(s) +2H2O(l)
Si on fixe la pression en sulfure d'hydrogène égale à 1 bar, à 20°C, la concentration en sulfure d'hydrogène en solution aqueuse reste constante et égale à [H2S]= 0,10 mol/L. On considère une solution contenant des ions nickel et des ions manganèse telle que [Ni2+]=[Mn2+]=0,010 mol/L. On fait barboter, sous une pression de 1 bar, le sulfure d'hydrogène dans la solution et on étudie la précipitation des sulfure MnS et NiS. Ecrire les équations de précipitation des deux solides NiS et MnS. NiS(s) = Ni2+(aq) + S2-(aq). Mn(s) =Mn2+(aq) + S2-(aq). Donner l'expression de leur produit de solubilité Ks. Ks1 = [Ni2+][S2-] Ks2 = [Mn2+][S2-] A partir du produit des constantes d'acicité Ka1 Ka2 et de la concentration [H2S], vérifier que [S2-]= 10-21 / [H3O+]2. Ka1 = [HS-][H3O+] / [H2S] Ka2 = [S2-][H3O+] / [HS-] Ka1 Ka2 = [H3O+] 2 [S2-] / [H2S] avec Ka1 Ka2 = 10-20 et [H2S] = 0,1 mol/L [S2-] = Ka1 Ka2 [H2S] / [H3O+] 2 [S2-] = 0,1 10-20 / [H3O+] 2 = 10-21 /[H3O+] 2 . Sachant que la solution est tamponnée à pH=2, quel est (sont) l'ion ( les ions) qui précipite (nt). Justifier. [S2-] = 10-21 / (10-2 )2= 10-17 mol/L [Ni2+][S2-] = 0,01 * 10-17 = 10-19, valeur supérieure à Ks1 = 10-21 : le produit de solubilité étant atteint, NiS précipite. [Mn2+][S2-] = 0,01 * 10-17 = 10-19, valeur inférieure à Ks1 = 10-16 : le produit de solubilité n'étant pas atteint, MnS ne précipite pas.
|
|||||
|
|
|||||
|
|