|
Cinétique chimique ; spectrophotométrie ; absorption, émission, niveau d'énergie de l'atome bac Amérique du sud 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
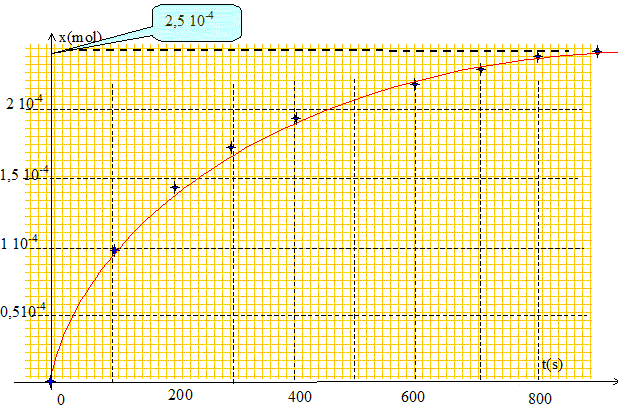
On se propose d'étudier la cinétique de la réaction entre l'eau oxygénée H2O2 et les ions iodure I- en milieu acide. Les couples oxydant/réducteur mis en jeu sont : H2O2 (aq) / H2O (l) et I2(aq) / I- (aq). L'équation de la réaction est : H2O2 (aq) + 2 I-(aq)+ 2 H+(aq) = 2 H2O (l) +I2(aq). Parmi les espèces chimiques présentes dans le système, seul le diiode I2 est coloré. Expliquer pourquoi on peut utiliser un spectrophotomètre pour suivre l'évolution de la transformation. Une seule espèce est colorée, le diiode, l'un des produits. En réglant le spectrophotomètre à la longueur d'onde d'absorption maximale du diiode, on peut mesurer l'absorbance A. Or l'absorbance est proportionnelle à la concentration du diiode. On peut donc suivre l'évolution de la concentration du diiode au cours du temps. Compléter le tableau descriptif de l'évolution du système.
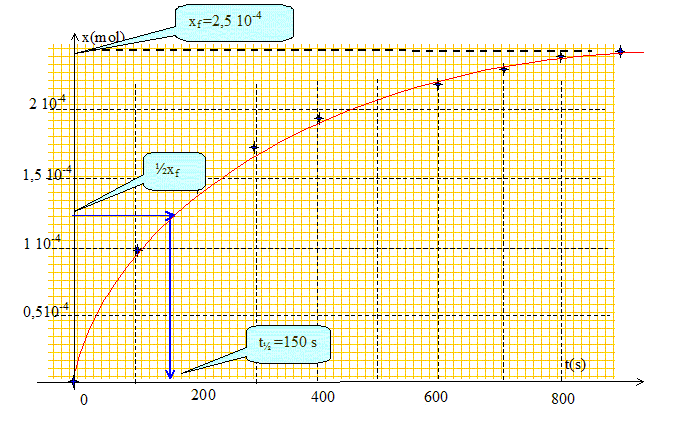
Déduire de la courbe la valeur de l'avancement final. Lorsque le temps est supérieur à 800 s, la courbe se rapproche de l'asymptote horizontale x = 2,5 10-4 mol. L'avancement final est égal à xf = 2,5 10-4 mol. Déterminer l'avancement maximal, puis le taux d'avancement final. La transformation peut-elle être considérée comme totale ? A partir du tableau d'avancement : si H2O2 (aq) est le réactif limitant : 2,5 10-4 -xmax = 0 ; xmax = 2,5 10-4 mol si I- (aq) est le réactif limitant : 1,5 10-3 -2xmax = 0 ; xmax = 7,5 10-4mol. L'avancement maximal correspond à la plus petite valeur soit xmax = 2,5 10-4 mol. Le taux d'avancement final vaut t = xf / xmax =1. En conséquence la transformation peut être considérée comme totale. Définir de manière générale le temps de demi-réaction. Le temps de demi réaction t½ est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final. Déterminer graphiquement la valeur numérique du temps de demi-réaction.
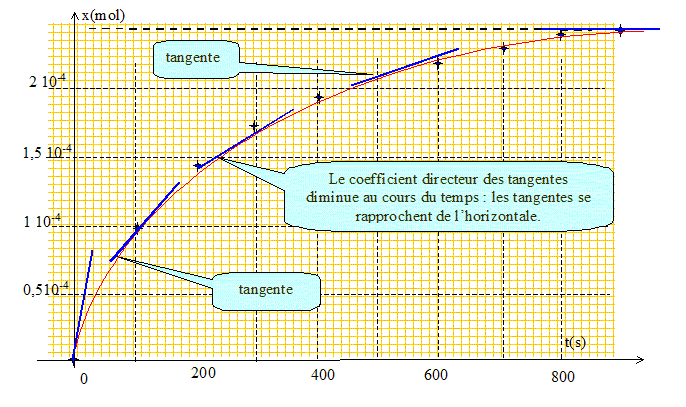
La vitesse volumique de réaction est définie par la relation : v =1/V dx/dt Comment évolue la vitesse de réaction en fonction du temps ? Justifier en utilisant la courbe x = f(t). La vitesse est proportionnelle au coefficient directeur de la tangente à la courbe à la date t donnée.
La vitesse diminue donc au cours du temps.
La
célérité de la lumière
dans le vide est :
c = 3,0
108
m.s-1. La constante de Planck
vaut h = 6,62
10-34
J.s.
Lorsqu'une radiation monochromatique traverse une fente, l'écart angulaire q du faisceau diffracté qu'il présente avec la direction moyenne de propagation est donné par : q =l/a . Que représente l ? Que représente a ? Quelles sont les unités, dans le système international, de q, l, et a ? l : longueur d'onde ( m) ; a : largeur de la fente (m) ; q : angle en radian.
Le spectrophotomètre utilise une source de lumière blanche. Cette lumière est envoyée sur un réseau : ensemble de fentes très fines parallèles entre elles et équidistantes qui diffractent la lumière. Quelle condition sur la largeur d'une fente est nécessaire pour que le phénomène de diffraction soit nettement observable ? La largeur de la fente doit être du même ordre de grandeur que la longueur d'onde de la lumière.
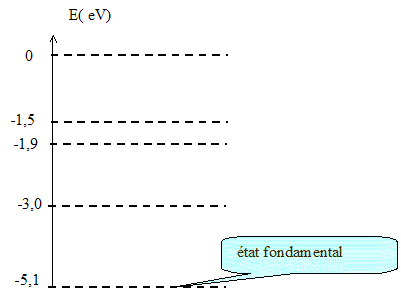
Émission ou absorption d'une radiation par un atome. Une fenêtre étroite qui peut se déplacer dans le spectre permet de sélectionner une radiation quasi monochromatique de longueur d'onde 580 nm. Celle-ci est choisie pour que l'absorption de la lumière par la solution colorée soit maximale afin que les mesures soient les plus précises possibles. Une radiation de longueur d'onde donnée peut être émise par un atome dont l'énergie diminue. Quelle est la relation entre la fréquence n de la radiation et sa longueur d'onde l dans le vide ? n= c/l. La radiation utilisée dans le spectrophotomètre a une longueur d'onde dans le vide l = 580 nm, calculer sa fréquence. n= 3,0 108 / 580 10-9 = 5,172 1014 Hz = 5,2 1014 Hz. La relation exprimant l'énergie perdue par l'atome est DE = h.n. Préciser la signification de chaque terme et leur unité dans le système international. DE : énergie en joule ; n. fréquence en hertz ; h : constante de Planck h = 6,62 10-34 J.s. Calculer l'énergie perdue par un atome qui émet la radiation de longueur d'onde dans le vide 580 nm. DE = 6,62 10-34*5,172 1014 =3,424 10-19 = 3,4 10-19 J. Exprimer cette énergie en électron-volt. Donnée : 1eV = 1,6 10-19 J. 3,424 10-19 /1,6 10-19 =2,140 eV = 2,1 eV. Le diagramme simplifié des niveaux d'énergie de l'atome considéré est donné.
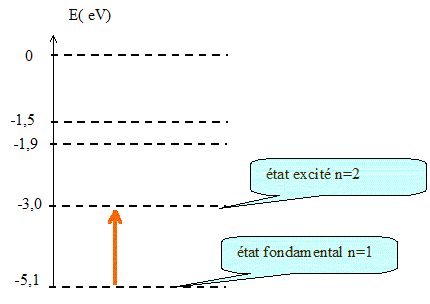
L'atome dans son état fondamental reçoit une radiation dont le quantum d'énergie est 2,1 eV. Cette radiation peut-elle interagir avec l'atome ? Justifier. Cette radiation peut être absorbée par l'atome car l'énergie de cette radiation est égale à la différence d'énergie entre l'état fondamental et le premier état excité de l'atome. Représenter, sur le diagramme donné, la transition associée par une flèche.
Cette transition correspond-elle à une émission ou à une absorption ? L'atome absorbe le quantum énergétique : l'énergie de l'atome augmente. Cette transition correspond à une absorption. Que se passe-t-il pour l'atome si, dans son état fondamental, il reçoit une radiation dont le quantum d'énergie est de 3,0 eV ? Justifier. Cette radiation ne peut pas être absorbée par l'atome car l'énergie de cette radiation n'est pas égale à la différence d'énergie entre l'état fondamental et un état excité de l'atome. en effet :-5,1 + 3 = -2,1 eV Aucun état excité ne possède l'énergie -2,1 eV.
|
||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||